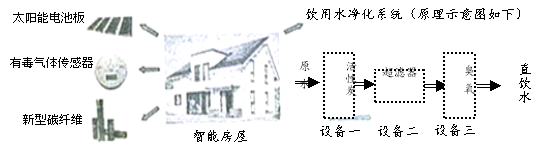
题目内容
【题目】向H2SO4和CuSO4的混合溶液中,不断加入NaOH溶液,下列图像横坐标表示加入NaOH溶液质量,纵坐标表示反应的有关变化情况,其中正确的是 .
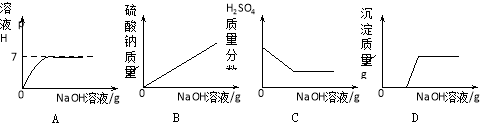
【答案】D
【解析】
试题分析:A、H2SO4和CuSO4的混合溶液,显酸性,当加入的NaOH溶液过量时,溶液显碱性,pH>7,错误;B、向H2SO4和CuSO4的混合溶液中,不断加入NaOH溶液,硫酸钠的质量从零开始逐渐变大,当H2SO4和CuSO4的混合溶液反应完时,反应停止,硫酸钠的质量不再增大,错误;C、向H2SO4和CuSO4的混合溶液中,不断加入NaOH溶液,硫酸与氢氧化钠先发生中和反应,硫酸的质量逐渐减小,最后硫酸的质量应该减小为零,错误;D、向H2SO4和CuSO4的混合溶液中,不断加入NaOH溶液,硫酸与氢氧化钠先发生中和反应、硫酸反应完以后氢氧化钠溶液才与CuSO4溶液反应生成沉淀,当CuSO4溶液反应完以后,再加入NaOH溶液,反应也不再发生,沉淀质量不再增多,正确。故选D

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】炼铁产生的废渣中含有大量CuS及少量铁和铁的化合物,工业上以该废渣为原料生产CuCl2的流程图如下:

(1)操作1把废渣粉碎的目的 。
(2)在废渣粉末中加入NaCl和O2的目的是:CuS、NaCl和O2在高温条件下反应生成CuCl2和Na2SO4,写出该反应的化学方程式 。
(3)【查阅资料】:不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。下表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
操作3的名称是 ,其中用到玻璃棒的作用是 。在此操作之前,为了使溶液中的Fe3+变成Fe(OH)3沉淀而除去,你认为调节溶液的pH到 (填数值范围)比较合适。
(4)流程图中能循环利用的物质是 和水。