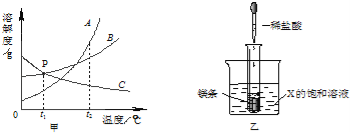
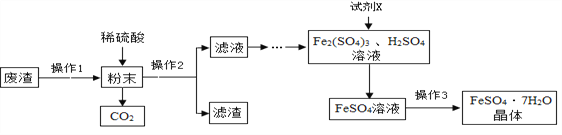
题目内容
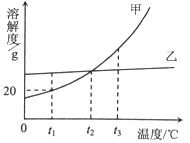
【题目】下表是NaCl和KNO3在不同温度时的溶解度:
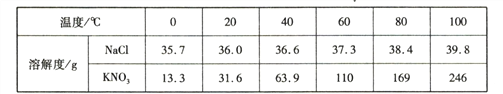
(1)从表中数据可以看出NaCl和KNO3的溶解度随温度升高而 ________(填“增大”或“减小”)
(2)若将KNO3的不饱和溶液变为相同温度下饱和溶液,其方法为____(填一种)。
若KNO3饱和溶液中含有少量NaCl时,提纯的方法是_______(填一种)。
(3)下列有关说法正确的是______ :
a.40℃时,KNO3溶液的溶质质量分数一定比NaCl溶液的演技质量分数大
b. KNO3饱和溶液中一定不能再溶解NaCl固体
c.从表中数据可以判断NaCl和的KNO3溶解度相等的温度在20-40℃之间
【答案】 增大 加入KNO3 固体 (或蒸发溶剂 ) 冷却热饱和溶液(或降温结晶) c
【解析】(1)由表格数据可知,NaCl和KNO3的溶解度随温度升高而增大;(2)将KNO3的不饱和溶液变为相同温度下饱和溶液,方法有:加溶质硝酸钾、恒温蒸发溶剂水;硝酸钾的溶解度受温度的影响变化较大,故要提纯硝酸钾采用降温结晶的方法;(3)A、40℃时,硝酸钾的溶解度大于氯化钠的溶解度,故40℃时,饱和的KNO3溶液的溶质质量分数一定比NaCl溶液的溶质质量分数大,错误;B、溶解度指的是某温度下,在100g溶剂中溶解某种溶质达到饱和状态时所溶解的质量,即温度不变时,KNO3饱和溶液中一定不能再溶解硝酸钾固体,但可以溶解氯化钠固体,错误;由表格数据可知温度在20-40℃之间,硝酸钾和氯化钠的溶解度有一相交的部分,即NaCl和的KNO3溶解度相等的温度在20-40℃之间,正确。

 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】乙炔(C2H2)气体和氧气反应能产生高温火焰,工人师傅常用氧炔焰切割或焊接金属。乙炔由碳化钙(块状固体,化学式为CaC2)与水反应生成,同时生成一种白色固体。
【提出问题】白色固体是什么物质?
【做出猜想】小明经过思考认为有以下几种可能:
猜想一:CaO;猜想二: ;猜想三:Ca(OH)2,他的依据是 。
【交流反思】经过同学们交流讨论,认为猜想一不成立。否定猜想一的理由是: 。
【进行实验】
实验操作 | 实验现象 | 实验结论 |
取少量白色固体放入试管中,滴加稀盐酸。 | 。 | 猜想二不成立:不是CaCO3。 |
取少量白色固体加入到水中,取上层清液, 。 | 。 | 猜想三成立:白色固体是Ca(OH)2 |
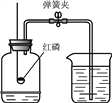
【拓展应用】已知碳化钙与水反应非常剧烈,乙炔的密度比空气略小,难溶于水。实验室欲制取并收集纯净的乙炔,要求做到节约、安全、随时发生、随时停止,你选择的装置是(填图中装置序号) 。