题目内容
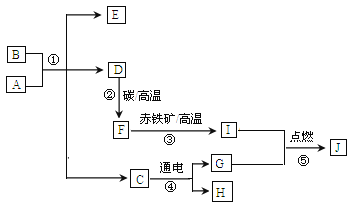
【题目】以 CuSO4 为原料制备碱式碳酸铜[Cu2(OH)2CO3]的过程如下:
(资料)碱式碳酸铜受热易分解:Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
(1)“沉淀”时的反应为:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2______ +CO2↑
(2)检验沉淀是否洗涤干净应选用的试剂是_______ (填化学式),烘干时若产品出现少量 黑色物质,可能的原因为________.
(3)若所得产品的产率偏高,可能的原因为_______ (填序号)
A.反应物未完全沉淀 B.过滤时滤纸破损
C.Cu2(OH)2CO3 未洗涤干净 D.Cu2(OH)2CO3 未完全烘干
【答案】 Na2SO4 BaCl2 部分碱式碳酸铜在烘干时分解生成黑色的氧化铜 CD
【解析】(1)根据质量守恒定律分析解答;(2)根据流程,要使得硫酸铜完全反应,加入的 Na2CO3溶液必然要过量。此外根据生成碱式碳酸铜的方程式,最终过滤得到的滤渣,表面附着的溶液中,溶质为剩余的Na2CO3和Na2SO4分析解答;根据碱式碳酸铜受热易分解分析解答;(3)根据操作过程中可能造成的误差分析解答。(1)反应前有2个铜原子、2个硫原子、15个氧原子、2个碳原子、4个钠原子和2个氢原子,反应后2个铜原子、0个硫原子、7个氧原子、2个碳原子、0个钠原子和2个氢原子,依据化学反应前后原子的种类和个数不变可知,2___中有4个钠原子、2个硫原子、8个氧原子,所以___化学是为Na2SO4;(2) 根据流程,要使得硫酸铜完全反应,加入的Na2CO3溶液必然要过量。此外根据生成碱式碳酸铜的方程式,最终过滤得到的滤渣,表面附着的溶液中,溶质为剩余的Na2CO3和Na2SO4,因而洗涤的目的就是洗去这两种物质。故判断是否洗涤干净的方法是在洗出液中滴加 BaCl2溶液,通过观察有无沉淀生成来判别;烘干时产品中出现少量黑色物质,可能的原因为部分碱式碳酸铜受热分解为氧化铜;(3)A、反应物为完全沉淀,无影响;B、过滤时滤纸破损,产品的实际质量减少,所得产品的产率降低;C、Cu2(OH)2CO3未洗涤干净产品的实际质量增大,所得产品的产率偏高;D、Cu2(OH)2CO3未完全烘干,所得产品的产率偏高。故选CD。

【题目】NH4Cl和Na2SO4的溶解度表及溶解度曲线如图.下列说法错误的是( )

温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度S/g | NH4Cl | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 60.2 |
Na2SO4 | 9.6 | 20.2 | 40.8 | 48.4 | 47.5 | 47.0 | |
A. 乙为NH4Cl
B. t3应介于40℃﹣50℃
C. 55℃时,分别将两饱和溶液蒸发等质量的水,得到固体质量甲>乙
D. 等质量的甲、乙饱和溶液从t3降温到t1,析出的晶体质量相等
【题目】下列图像不能正确反映其对应关系的是
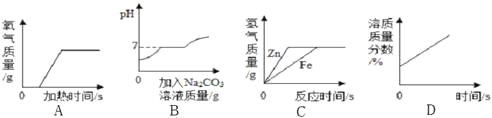
A. 加热一定质量的高锰酸钾
B. 向盐酸和氯化钙的混合溶液中不断滴加碳酸钠溶液
C. 向等质量等质量分数的稀盐酸中分别加入过量的锌和铁
D. 浓硫酸敞口放在空气中
【题目】小明在实验室发现一瓶氢氧化钠固体没有塞上瓶塞,于是他和他的同学一起对这瓶氢氧化钠固体展开探究,请你与他们一起进行探究。
【提出问题】这瓶氢氧化钠固体是否变质?
【猜想与假设】:①该氢氧化钠没有变质;②该氢氧化钠部分变质;③该氢氧化钠全部变质。
【查阅资料】CaCl2溶液呈中性。
【设计实验】取该氢氧化钠固体样品溶于水配成溶液A,进行如下实验:
实验步骤 | 实验现象 | 结论及解释 |
(1)取少量溶液A于试管中,向其中滴加足量的稀盐酸; | ___________ | 猜想①不成立 |
(2)另取少量溶液A于试管中,向其中滴加足量的氯化钙溶液; | ____________ | 反应的化学方程式为: ______________ |
(3)将步骤(2)所得的混合液静置,向上层清液中滴加无色的酚酞溶液。 | 溶液呈红色 | 猜想 ________ 成立 |
【反思与交流】
(4)久置的氢氧化钠变质的原因是(用化学方程式表示) ___________________ 。
【探索与拓展】为进一步探究氢氧化钠的变质程度,小明称取18.6 g氢氧化钠固体样品放入烧杯中,向其中逐滴加入稀盐酸,到不再产生气泡为止,共消耗稀盐酸100 g,反应后称得烧杯中溶液的质量为114.2 g。
(5)求该样品中碳酸钠的质量(要写出计算过程)。____________。
(6)该氢氧化钠的变质程度(即变质的氢氧化钠占变质前的氢氧化钠的质量分数)为______ 。