题目内容
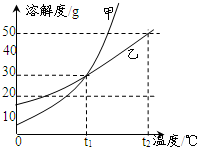 甲、乙两物质的溶解度曲线如图所示.下列叙述中不正确的是( )
甲、乙两物质的溶解度曲线如图所示.下列叙述中不正确的是( )分析:A、根据固体物质从溶液中结晶析出的方法考虑;B、根据饱和溶液的质量分数的计算方法考虑;C、根据升温后是否有溶质析出考虑;D、根据t2℃时甲和乙的溶解度考虑.
解答:解:A、如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液(或降温结晶),如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.由于甲物质的溶解度随温度变化比较大,所以从溶液中获得甲晶体,适宜采用降温结晶的方法,故A说法正确;
B、饱和溶液的质量分数可以用该公式计算:
×100%,所以饱和溶液的质量分数取决于溶解度的大小,t1℃时,甲和乙的溶解度相等,所以饱和溶液的质量分数相等,故B说法正确;
C、把t1℃时甲、乙的饱和溶液升温至t2℃时,都变为不饱和溶液,溶质和溶剂质量都没有变化,溶质质量分数不变,故C说法错误;
D、t2℃时,将甲、乙的饱和溶液都蒸发掉10g水,析出晶体的质量与10g水中溶解的溶质多少有关,即与t2℃时,甲、乙的溶解度有关,因为在t2℃时,甲的溶解度大于乙的溶解度,所以t2℃时,将甲、乙的饱和溶液都蒸发掉10g水,甲析出的晶体质量大,故D说法正确.
故选C.
B、饱和溶液的质量分数可以用该公式计算:
| 溶解度 |
| 100g+溶解度 |
C、把t1℃时甲、乙的饱和溶液升温至t2℃时,都变为不饱和溶液,溶质和溶剂质量都没有变化,溶质质量分数不变,故C说法错误;
D、t2℃时,将甲、乙的饱和溶液都蒸发掉10g水,析出晶体的质量与10g水中溶解的溶质多少有关,即与t2℃时,甲、乙的溶解度有关,因为在t2℃时,甲的溶解度大于乙的溶解度,所以t2℃时,将甲、乙的饱和溶液都蒸发掉10g水,甲析出的晶体质量大,故D说法正确.
故选C.
点评:解答本题关键是要知道溶解度曲线表示的意义,知道溶解度如何比较大小,饱和溶液溶质质量分数的计算公式,固体物质从溶液中结晶析出的方法.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
根据下表的数据判断,下列有关说法正确的是( )
| 温度 物质 |
0℃ | 20℃ | 30℃ | 50℃ | 80℃ |
| 甲 | 13.3g | 31.6g | 36.2g | 85.8g | 169g |
| 乙 | 35.7g | 36.0g | 36.2g | 36.5g | 37.1g |
| A、甲的溶解度大于乙的溶解度 |
| B、升高温度可把甲的不饱和溶液变为饱和溶液 |
| C、在溶解度曲线图上,甲、乙两物质的溶解度曲线在30℃时相交,此时甲、乙两种物质饱和溶液的溶质质量分数均为26.6% |
| D、使乙物质从它的一定温度下的饱和溶液中析出,一般采用冷却法 |


 (2011?南岗区一模)如图所示为甲、乙两物质的溶解度曲线.20℃时,取甲、乙两种物质(均不含结晶水)各30g,分别加入到100g水中,使之充分溶解,得到相应的混合物.下列有关说法不正确的是( )
(2011?南岗区一模)如图所示为甲、乙两物质的溶解度曲线.20℃时,取甲、乙两种物质(均不含结晶水)各30g,分别加入到100g水中,使之充分溶解,得到相应的混合物.下列有关说法不正确的是( ) (2011?绥化)甲、乙两种固体物质(不含结晶水)的溶解度曲线如下图所示.下列说法正确的是( )
(2011?绥化)甲、乙两种固体物质(不含结晶水)的溶解度曲线如下图所示.下列说法正确的是( )