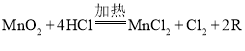题目内容
【题目】向一定质量的Zn(NO3)2和AgNO3混合溶液中加入ag铜粉,充分反应后过滤,得到某温度下的不饱和溶液和滤渣。下列有关说法错误的是
A.滤渣的质量一定大于ag
B.所得溶液中可能含有AgNO3
C.整个过程中Zn(NO3)2的质量不变
D.滤渣中一定含有单质Cu和单质Ag
【答案】D
【解析】
由题意向一定质量的Zn(NO3)2和AgNO3混合溶液中加入ag铜粉,根据金属活动性顺序锌>铜>银可知,铜与硝酸银反应生成硝酸铜和银,充分反应后过滤,得到某温度下的不饱和溶液和滤渣,可能出现以下情况:①铜粉量不足,硝酸银有剩余,得到硝酸锌、硝酸铜和硝酸银的混合溶液,滤渣的成分为银;②铜粉与硝酸银恰好完全反应,得到硝酸锌、硝酸铜的混合溶液,滤渣的成分为银;③铜粉有剩余,硝酸银完全反应,得到硝酸锌、硝酸铜的混合溶液,滤渣的成分为银和铜。则有:
A、铜与硝酸银反应生成硝酸铜和银,反应的方程式为![]() ,根据方程式可知每64份质量的铜参与反应可以置换出216份质量的银,反应生成的银的质量大于反应消耗的铜的质量,无论出现上述分析中的哪种情况,滤渣的质量一定大于ag,A选项说法正确,不符合题意;
,根据方程式可知每64份质量的铜参与反应可以置换出216份质量的银,反应生成的银的质量大于反应消耗的铜的质量,无论出现上述分析中的哪种情况,滤渣的质量一定大于ag,A选项说法正确,不符合题意;
B、当铜粉量不足,硝酸银有剩余,得到硝酸锌、硝酸铜和硝酸银的混合溶液,所得溶液中可能含有AgNO3,B选项说法正确,不符合题意;
C、根据金属活动性顺序锌>铜>银可知,铜、银均不与硝酸锌反应,因此整个过程中Zn(NO3)2的质量不变,C选项说法正确,不符合题意;
D、当铜粉量不足,硝酸银有剩余,得到的滤渣的成分为银;当铜粉与硝酸银恰好完全反应,得到的滤渣的成分为银;当铜粉有剩余,硝酸银完全反应,得到的滤渣的成分为银和铜;因此滤渣中一定含有单质Ag,可能含有单质Cu,D选项说法不正确,符合题意。故选D。

【题目】某兴趣小组发现,上周做实验用的氢氧化钠固体忘记了盖瓶盖,他们欲对该固体的变质情况进行探究。
(提出问题)该瓶氢氧化钠固体是否变质,变质情况如何?
(查阅资料)①碳酸钠溶液的pH最大约为10.6,饱和的碳酸氢钠溶液约为8.0,氯化钙溶液呈中性。
②NaOH、Na2CO3分别在水和酒精中的溶解度如下表所示:
物质种类 | NaOH | Na2CO3 | |||
温度 | 20℃ | 40℃ | 20℃ | 40℃ | |
溶剂 | 水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 | |
(作出猜想)猜想Ⅰ:固体未变质;
猜想Ⅱ:固体部分变质;
猜想Ⅲ:固体全部变质。
(实验探究)(1)兴趣小组同学取少量样品于烧杯中,加适量水溶解,测得溶液的pH约为12。由此他们得出猜想Ⅰ正确,但其他同学很快予以否定,否定的理由是______。
(2)组内其他同学取步骤(1)烧杯中少量溶液于试管中,加入过量的____溶液,振荡,有白色沉淀生成;不再产生沉淀时,取上层清液于另一支试管中,滴加____,溶液变红。
(实验结论)通过实验,兴趣小组证明猜想__正确。
(反思评价)根据查阅资料,有同学提出可以通过氢氧化钠和碳酸钠在酒精中溶解度不同来验证猜想Ⅲ正确。请你帮助他设计实验方案:_____。
(实验拓展)实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量。称取一定量样品,溶于水配成250.0mL溶液将pH=1的稀盐酸逐滴加入体积为25.0mL的该溶液中,所得曲线如图所示:
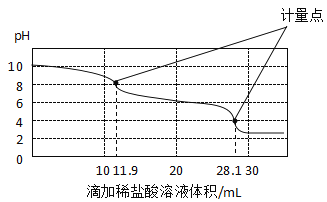
a.上一个计量点前发生反应的化学方程式为_____。
b.下一个计量点时溶液中大量存在的阴离子是_______。