题目内容
【题目】化学兴趣小组对某工业废水(溶质为HCl、NaCl)中的HCl含量进行测定,甲、乙两位同学各提供不同的测定方法:
(1)甲同学:酸碱中和法 取50g废水于烧杯中,逐滴滴入溶质质量分数为10%的NaOH溶液,反应过程中溶液的pH变化如图所示,求废水中HCl的质量分数(写出详细的计算过程).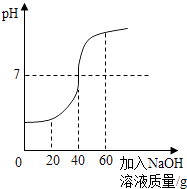
(2)乙同学:沉淀法 改用AgNO3溶液代替NaOH溶液,根据生成沉淀的质量来确定废水中HCl的质量分数,你认为结果将(填“偏大”“偏小”或“无影响”).
【答案】
(1)解:设废水中氯化氢的质量为x
HCl+ | NaOH=NaCl+H2O |
36.5 | 40 |
x | 40g×10%=4g |
![]()
解得:x=3.65g
废水中HCl的质量分数: ![]() =7.3%
=7.3%
答:废水中HCl的质量分数为7.3%;
(2)偏高
【解析】(2)硝酸银溶液可以和盐酸反应生成氯化银沉淀,也可以和氯化钠溶液反应生成氯化银沉淀,所以会导致测定结果偏高. 故填:偏高.
(1)盐酸可以和氢氧化钠发生中和反应,它们恰好完全反应时溶液呈中性,分析图象可以知道恰好完全反应时消耗氢氧化钠溶液的质量为40g,可以据此结合反应的化学方程式可以计算出废水中盐酸的质量;(2)AgNO3溶液可以和盐酸反应生成氯化银沉淀,也可以和溶液反氯化钠应生成硫酸钡沉淀,可以据此进行分析并完成解答.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目