题目内容
人类的生活和生产都离不开金属材料。
(1)金属以矿物形式存在,下列矿石的主要成分属于氧化物的是_______(填化学式)。

(2)铁是应用最广泛的金属。
①下列金属制品的用途中,利用金属导热性的是 (填字母序号)。

②还原铁粉又称“双吸剂”,常用于食品保鲜,其原理是:______________________________________。
③下列说法正确的是 。
(3)某工厂废液中含有氯化钠、氯化铜和氯化亚铁。某课外小组利用废液制取海绵铜(Cu)和氧化铁两种产品,过程如下图所示(过程中不引入其他元素)。

请回答:
①固体B的成分是 。
②检验C过量的方法是 。
(1)金属以矿物形式存在,下列矿石的主要成分属于氧化物的是_______(填化学式)。

(2)铁是应用最广泛的金属。
①下列金属制品的用途中,利用金属导热性的是 (填字母序号)。

②还原铁粉又称“双吸剂”,常用于食品保鲜,其原理是:______________________________________。
③下列说法正确的是 。
| A.来铁和铁合金都容易被锈蚀 |
| B.回收废旧金属有利于节约金属资源 |
| C.铁丝在氧气中剧烈燃烧,火星四射,生成氧化铁 |
| D.在铁桶中加入硫酸铜溶液和石灰乳来配制农药波尔多液 |

请回答:
①固体B的成分是 。
②检验C过量的方法是 。
(1)Fe2O3 Al2O3 (2)①A ②铁同时与水和氧气接触会生锈 ③ B
(3)①Fe 和Cu ②取少量溶液E于试管中,向其中加入适量的铁粉,若有气泡产生,则盐酸过量(合理给分)
(3)①Fe 和Cu ②取少量溶液E于试管中,向其中加入适量的铁粉,若有气泡产生,则盐酸过量(合理给分)
试题分析:(1)氧化物是指由两种元素组成且其中一种是氧元素的化合物。所以Fe2O3和Al2O3属于氧化物。Cu2(OH)2CO3中的元素四种,不符合要求。
(2)①铁锅利用铁有良好的导热性;铜导线利用铜有良好的导电性;铝箔利用铝有良好的延展性。
②铁粉作双吸剂是因为铁能与氧气和水共同反应,生成铁锈。同时除去了氧气和水,用于食品保鲜。
③A铁容易被锈蚀,但铁的合金---不锈钢不易被锈蚀,此项错误。B回收废旧金属既有利于保护环境,又能节约金属资源和能源。此项正确。C铁丝在氧气中剧烈燃烧,火星四射,生成黑色的四氧化三铁。此项错误。D由于铁的活动性比铜强,所以铁能与硫酸铜溶液反应生成铜和硫酸亚铁,造成配制的药液药效降低或失去。此项错误。
(3)在氯化钠、氯化铜和氯化亚铁三种盐溶液中,三种金属的活动性由强到弱的顺序依次为:钠、铁、铜。所以可以在其混合溶液中加入铁将铜置换出来。所以A是指铁。铁和氯化铜溶液反应,生成铜和氯化亚铁溶液。操作1将混合物分成了溶液D和固体B,所以操作1为过滤。固体B中的成分为反应生的铜和过量而未反应的铁;溶液D的成分为氯化钠和氯化亚铁。要从固体B(铜和铁)中得到纯净铜,可以向其中加入酸液。因为铜与酸不反应,从而得到铜。结合本题,加入的酸应为盐酸。(铁和盐酸反应生成氯化亚铁,与上面的物质相对应,如加入别的酸会形成新的杂质)。所以C为盐酸,F为铜,E为氯化亚铁溶液和盐酸,G为氧化铁。
②因为C为盐酸,过量会造成E中含有。所以检验C过量的方法是:取少量溶液E于试管中,向其中加入适量的铁粉,若有气泡产生,则盐酸过量。

练习册系列答案
相关题目
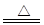 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑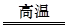 CO+H2
CO+H2
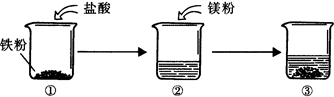
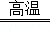 Ti+2MgCl2.反应说明金属钛的活动性比镁 (填强或弱).
Ti+2MgCl2.反应说明金属钛的活动性比镁 (填强或弱).