题目内容
某种离子A2+的核外有10个电子,核内的质子数与中子数相等,某阴离子B-的结构为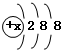 ,其原子核内有18个中子.试计算由A、B元素组成的化合物的相对分子质量.(要写明计算过程,无计算过程不得分)
,其原子核内有18个中子.试计算由A、B元素组成的化合物的相对分子质量.(要写明计算过程,无计算过程不得分)
 ,其原子核内有18个中子.试计算由A、B元素组成的化合物的相对分子质量.(要写明计算过程,无计算过程不得分)
,其原子核内有18个中子.试计算由A、B元素组成的化合物的相对分子质量.(要写明计算过程,无计算过程不得分)分析:根据原子中:核电荷数=质子数=电子数、相对原子质量=质子数+中子数,结合题意判断元素的种类并书写化学式分析解答即可.
解答:解:由阳离子A2+的核外有10个电子可知,A原子的电子为12个,故A原子的质子数为12,该元素是镁元素,又因质子数与中子数相同,故镁的相对原子质量为24.阴离子B-的结构为 ,说明该原子的核外电子数是17,则其核内质子数是17,是氯元素,其原子核内有18个中子,所以其相对原子质量约为17+18=35;镁元素(化合价为+2)和氯元素(化合价为-1)形成的化合物化学式为MgCl2;所以该化合物的相对分子质量为24+35×2=94;
,说明该原子的核外电子数是17,则其核内质子数是17,是氯元素,其原子核内有18个中子,所以其相对原子质量约为17+18=35;镁元素(化合价为+2)和氯元素(化合价为-1)形成的化合物化学式为MgCl2;所以该化合物的相对分子质量为24+35×2=94;
答:由A、B元素组成的化合物的相对分子质量为94;
 ,说明该原子的核外电子数是17,则其核内质子数是17,是氯元素,其原子核内有18个中子,所以其相对原子质量约为17+18=35;镁元素(化合价为+2)和氯元素(化合价为-1)形成的化合物化学式为MgCl2;所以该化合物的相对分子质量为24+35×2=94;
,说明该原子的核外电子数是17,则其核内质子数是17,是氯元素,其原子核内有18个中子,所以其相对原子质量约为17+18=35;镁元素(化合价为+2)和氯元素(化合价为-1)形成的化合物化学式为MgCl2;所以该化合物的相对分子质量为24+35×2=94;答:由A、B元素组成的化合物的相对分子质量为94;
点评:本题难度不大,理解题意、掌握原子中核电荷数=质子数=电子数、相对原子质量=质子数+中子数是正确解答本题的关键.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
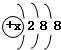 ,其原子核内有18个中子.试计算由A、B元素组成的化合物的相对分子质量.(要写明计算过程,无计算过程不得分)
,其原子核内有18个中子.试计算由A、B元素组成的化合物的相对分子质量.(要写明计算过程,无计算过程不得分) ,其原子核内有18个中子.试计算由A、B元素组成的化合物的相对分子质量.(要写明计算过程,无计算过程不得分)
,其原子核内有18个中子.试计算由A、B元素组成的化合物的相对分子质量.(要写明计算过程,无计算过程不得分)