题目内容
【题目】同学们完成实验后留下的废液中含有K2CO3、KCl和Na2SO4三种物质,在老师的指导下,化学小组的同学设计以下流程回收KCl晶体。
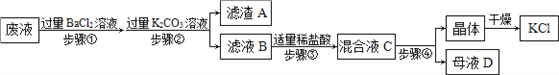
请回答:
(1)步骤①反应的化学方程式____________________、______________________。
(2)步骤②加入过量K2CO3溶液的目的是____________________________________;滤液B中的溶质是_______________、_____________、_______________(写化学式)。
(3)步骤③判断盐酸适量的现象是_________________________________________。
(4)混合液C中的溶质是KCl和NaCl,观察溶解度曲线,步骤④所包含的具体操作是______、降温结晶、过滤。降温结晶的最佳温度范围是________℃以下,晶体表面的杂质最好用______________________进行洗涤。
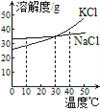
【答案】 K2CO3+BaCl2==BaCO3↓+2KCl Na2SO4+BaCl2==BaSO4↓+2NaCl 除去过量的BaCl2 KCl NaCl K2CO3 刚好不再有气泡冒出 蒸发浓缩 30 饱和KCl溶液
【解析】(1)步骤①加入过量的氯化钡溶液,氯化钡与碳酸钾反应生成碳酸钡和氯化钾,反应的化学方程式为:K2CO3+BaCl2==BaCO3↓+2KCl;氯化钡与硫酸钠反应生成硫酸钡和氯化钠,反应的化学方程式为:Na2SO4+BaCl2==BaSO4↓+2NaCl;
(2)加入过量K2CO3溶液的目的是除去过量的BaCl2,反应生成碳酸钡和氯化钾,所以液B中的溶质是氯化钾、氯化钠和过量的碳酸钾;
(3)步骤③加入盐酸与碳酸钾反应生成氯化钾、水和二氧化碳气体,所以盐酸适量的现象是刚好不再有气泡冒出;
(4)由于氯化钾溶解度随温度升高而增大,氯化钠的溶解度几乎不受温度的影响,所以要分离氯化钠和氯化钾可以蒸发浓缩形成热饱和溶液,降温结晶、过滤。由于氯化钾的溶解度在30℃以下比氯化钠小,酸钠的溶解度受温度影响比氯化钠大,降温的过程中会析出大量的氯化钾,所以,降温结晶的最佳温度范围是30℃以下;为防止氯化钾的溶解,晶体表面的杂质最好用饱和KCl溶液进行洗涤。