题目内容
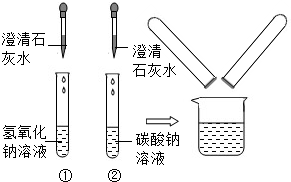
在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如图所示的实验.
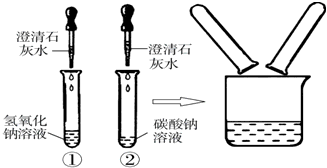
(1)写出试管②中碳酸钠与氢氧化钙反应的化学方程式:________.
(2)实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.
提出问题:滤液中除水外还含有哪些物质?
猜想:小红认为:只含氢氧化钠;
小明认为:可能含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:可能含有氢氧化钠和碳酸钠;
你认为还可能是________(写一种猜想).
讨论:你认为小红、小明、小亮三位同学中谁的猜想不合理,请说明理由.________.
实验设计:设计一个简单的实验证明你的猜想正确.
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,________ | ________ | 你的猜想正确 |
解:(1)碳酸钠和氢氧化钙反应生成白色的碳酸钙沉淀和氢氧化钠,反应的方程式为:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)猜想:根据反应原理可知,两者可能恰好完全反应,也可能其中的一种过量,结合已有的猜想,故猜想为:氢氧化钠和氢氧化钙;
讨论:碳酸根离子和钙离子会直接反应生成碳酸钙沉淀.所以,小明猜想不合理,因为Na2CO3和Ca(OH)2能发生反应,不能共存;
实验设计:由于氢氧化钙溶液能与二氧化碳反应生成沉淀,所以,设计实验如下:
反思拓展:根据上面的检验可知溶液显碱性,一般中性的溶液才能排入下水道中,故处理的措施是:在废液中加酸至溶液的pH=7.
故答为:(1)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;(2)猜想:氢氧化钠和氢氧化钙;讨论:小明猜想不合理,因为Na2CO3和Ca(OH)2能发生反应,不能共存;实验设计:实验步骤:通入二氧化碳气体; 实验现象:试管中出现白色浑浊;反思拓展:在废液中加酸至溶液的pH=7.
分析:(1)根据反应物、生成物以及反应原理书写方程式;
(2)猜想:根据碳酸钠和氢氧化钙反应时,可能刚好完全反应,也可能其中的一种过量,结合题中的猜想进行分析;
讨论:根据碳酸钙离子和钙离子会生成沉淀进行分析;
实验设计:根据猜想,由氢氧化钙的特性,只要设计实验能验证氢氧化钙存在即可;
反思拓展:根据上面的分析可知废液显碱性,不能直接排入下水道进行分析.
点评:在做此类题时,首先弄清所要鉴别的物质的不同性质,然后选择适当的试剂进行鉴别,出现不同的现象,在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑反应物的过量问题.
(2)猜想:根据反应原理可知,两者可能恰好完全反应,也可能其中的一种过量,结合已有的猜想,故猜想为:氢氧化钠和氢氧化钙;
讨论:碳酸根离子和钙离子会直接反应生成碳酸钙沉淀.所以,小明猜想不合理,因为Na2CO3和Ca(OH)2能发生反应,不能共存;
实验设计:由于氢氧化钙溶液能与二氧化碳反应生成沉淀,所以,设计实验如下:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样品于试管中,通入二氧化碳气体 | 试管中出现白色浑浊 | 你的猜想正确 |
故答为:(1)Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;(2)猜想:氢氧化钠和氢氧化钙;讨论:小明猜想不合理,因为Na2CO3和Ca(OH)2能发生反应,不能共存;实验设计:实验步骤:通入二氧化碳气体; 实验现象:试管中出现白色浑浊;反思拓展:在废液中加酸至溶液的pH=7.
分析:(1)根据反应物、生成物以及反应原理书写方程式;
(2)猜想:根据碳酸钠和氢氧化钙反应时,可能刚好完全反应,也可能其中的一种过量,结合题中的猜想进行分析;
讨论:根据碳酸钙离子和钙离子会生成沉淀进行分析;
实验设计:根据猜想,由氢氧化钙的特性,只要设计实验能验证氢氧化钙存在即可;
反思拓展:根据上面的分析可知废液显碱性,不能直接排入下水道进行分析.
点评:在做此类题时,首先弄清所要鉴别的物质的不同性质,然后选择适当的试剂进行鉴别,出现不同的现象,在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑反应物的过量问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2011?泰安) 在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如右图所示的实验.
(2011?泰安) 在化学实验技能考试中,有一题目是鉴别碳酸钠溶液和氢氧化钠溶液,小红等几位同学进行了如右图所示的实验.