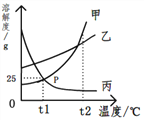
题目内容
【题目】某兴趣小组同学去盐场参观,带回了部分粗盐样品,并对其进行了如下探究:
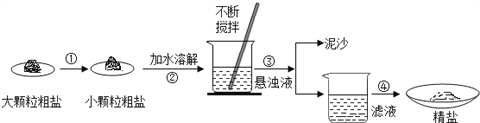
(1)操作③的名称是_________________
(2)操作④中用到玻璃棒,作用为_____________________。
(3)实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是__________(填序号)。
A.食盐没有全部溶解即过滤 B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿 D.器皿上沾有的精盐没全部转移到称量纸上。
(4)查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有MgCl2一种),为了得到较纯净的氯化钠,小组同学将所得的“精盐”又作了如下处理:
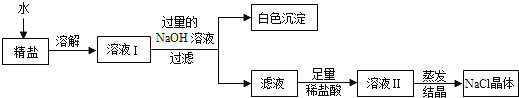
①白色沉淀的化学式为_______。
②在得到的滤液中加入足量的稀盐酸的目的是____________________。
【答案】 过滤 搅拌,防止局部温度过高造成液体飞溅 ABD Mg(OH)2 除去过量的氢氧化钠
【解析】(1)过滤可以将不溶物和可溶物分离,所以操作③的名称是过滤,操作④是蒸发,要用到玻璃棒,作用为搅拌,防止局部温度过高造成液体飞溅;(3)A、食盐没有全部溶解即过滤,会导致只得率偏低,正确;B、蒸发时食盐飞溅剧烈,会导致制得率偏低,正确;;C、蒸发后,所得精盐很潮湿,会导致制得率偏高,错误;D、器皿上沾有的精盐没全部转移到称量纸上,会导致制得率偏低,正确;(4)①氢氧化钠和氯化镁会生成氢氧化镁沉淀,所以白色沉淀的化学式为Mg(OH)2;②除去氯化镁加入的氢氧化钠是过量的,对于氯化钠也是杂质,所以在得到的滤液中加入足量的稀盐酸的目的是:除去反应剩余的氢氧化钠。

练习册系列答案
相关题目