题目内容
 我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐.
我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐.
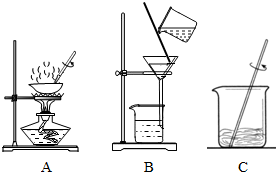
(1)取5g粗盐进行提纯,粗盐中除了含氯化钙外,还含有硫酸钠、氯化镁、氯化钙、泥沙等杂质,在粗盐提纯的过程中,正确的操作顺序是(填图中的序号)______,过滤时,玻璃棒的作用是______.
(2)甲同学得到的“精盐”明显比其他同学少,原因可能为______.
A.过滤不充分,滤渣洗涤不充分;B.蒸发时有液体溅出;C.蒸发后的固体转移不彻底.
(3)上述操作后,得到“精盐”是否为混合物,请你设计实验证明.
取少量“精盐”于洁净的试管中,加适量的水溶解,滴加______试剂,产生的现象是______,则此“精盐”是混合物.
(4)若将“精盐”中可溶性的杂质完全除去,需用①过量Na2CO3溶液;②过量BaCl2溶液;③过滤;④过量NaOH溶液;⑤适量稀盐酸.正确操作顺序为______.(填写序号)
解:粗盐提纯的主要步骤,
①溶解,将粗盐逐渐加入盛有水的烧杯里,边加边用玻璃棒搅拌(玻璃棒的作用是搅拌,加速溶解),直加到粗盐不再溶解时为止,观察所得食盐水是否浑浊;
②过滤,过滤食盐水,仔细观察滤纸上剩余物及滤液颜色,注意用玻璃棒来引流;
③蒸发,把所得滤液倒入蒸发皿,用酒精灯加热,待蒸发皿中出现较多固体时,停止加热,利用余热蒸干.
图中A是蒸发,B是过滤,C是溶解;B过滤实验中玻璃棒的作用是引流.蒸发过程中当看到有较多晶体析出时停止加热,利用余热蒸干;
(2))根据精盐的产率计算方法,A中过滤不充分,滤渣洗涤不充分,这样食盐的质量偏小,所以结果偏低;B中有液体或固体溅出,则造成精盐减少,分子偏小,计算结果偏低;C中固体没有转移彻底,则会使得到的精盐质量偏低,所以会使计算的结果偏低.故选ABC;
(3)若所制得的“精盐”中为混合物,则其中含有硫酸钠或是氯化钙或氯化镁等物质,所以可以用碳酸钠来进行检验,加入碳酸钠,若产生沉淀则说明该“精盐”为混合物;
(4)先加入氢氧化钠溶液将氯化镁除去,然后氯化钡溶液会将硫酸钠除去,而碳酸钠能够将氯化钙和剩余的氯化钡除去,最后用盐酸将碳酸钠和氢氧化钠除去,所以正确的操作顺序为:④②①③⑤.
故答案为:(1)CBA;引流;
(2))ABC;
(3)碳酸钠;产生沉淀;
(4)④②①③⑤.
分析:(1)粗盐提纯是通过溶解把不溶物与食盐初步分离、过滤把不溶物彻底除去、蒸发把食盐从溶液中分离出来而得到食盐的过程;其操作顺序应为溶解-过滤-蒸发;
(2)根据精盐的产率计算方法及操作过程的注意事项进行解答;
(3)粗盐中含有镁离子和钙离子都能和可溶性碳酸盐反应生成沉淀,所以可以用碳酸钠来检验该精盐是否为纯净物,可以据此设计实验;
(4)根据酸碱盐之间的反应规律分析,除去钙离子、镁离子和硫酸根离子,加入氢氧化钠除去镁离子,加入钡离子除去硫酸根离子,加入碳酸钠除去钙离子和剩余的钡离子,加入稀盐酸可以除去过量的碳酸钠,所以可以据此来进行解答该题..
点评:本题综合考查了粗盐的提纯及除杂质的方法,明确步骤,除去溶液中的钙离子、镁离子和硫酸根离子添加药品的顺序,注意碳酸钠要在氯化钡之后加,盐酸要在过滤之后的滤液中滴加.
①溶解,将粗盐逐渐加入盛有水的烧杯里,边加边用玻璃棒搅拌(玻璃棒的作用是搅拌,加速溶解),直加到粗盐不再溶解时为止,观察所得食盐水是否浑浊;
②过滤,过滤食盐水,仔细观察滤纸上剩余物及滤液颜色,注意用玻璃棒来引流;
③蒸发,把所得滤液倒入蒸发皿,用酒精灯加热,待蒸发皿中出现较多固体时,停止加热,利用余热蒸干.
图中A是蒸发,B是过滤,C是溶解;B过滤实验中玻璃棒的作用是引流.蒸发过程中当看到有较多晶体析出时停止加热,利用余热蒸干;
(2))根据精盐的产率计算方法,A中过滤不充分,滤渣洗涤不充分,这样食盐的质量偏小,所以结果偏低;B中有液体或固体溅出,则造成精盐减少,分子偏小,计算结果偏低;C中固体没有转移彻底,则会使得到的精盐质量偏低,所以会使计算的结果偏低.故选ABC;
(3)若所制得的“精盐”中为混合物,则其中含有硫酸钠或是氯化钙或氯化镁等物质,所以可以用碳酸钠来进行检验,加入碳酸钠,若产生沉淀则说明该“精盐”为混合物;
(4)先加入氢氧化钠溶液将氯化镁除去,然后氯化钡溶液会将硫酸钠除去,而碳酸钠能够将氯化钙和剩余的氯化钡除去,最后用盐酸将碳酸钠和氢氧化钠除去,所以正确的操作顺序为:④②①③⑤.
故答案为:(1)CBA;引流;
(2))ABC;
(3)碳酸钠;产生沉淀;
(4)④②①③⑤.
分析:(1)粗盐提纯是通过溶解把不溶物与食盐初步分离、过滤把不溶物彻底除去、蒸发把食盐从溶液中分离出来而得到食盐的过程;其操作顺序应为溶解-过滤-蒸发;
(2)根据精盐的产率计算方法及操作过程的注意事项进行解答;
(3)粗盐中含有镁离子和钙离子都能和可溶性碳酸盐反应生成沉淀,所以可以用碳酸钠来检验该精盐是否为纯净物,可以据此设计实验;
(4)根据酸碱盐之间的反应规律分析,除去钙离子、镁离子和硫酸根离子,加入氢氧化钠除去镁离子,加入钡离子除去硫酸根离子,加入碳酸钠除去钙离子和剩余的钡离子,加入稀盐酸可以除去过量的碳酸钠,所以可以据此来进行解答该题..
点评:本题综合考查了粗盐的提纯及除杂质的方法,明确步骤,除去溶液中的钙离子、镁离子和硫酸根离子添加药品的顺序,注意碳酸钠要在氯化钡之后加,盐酸要在过滤之后的滤液中滴加.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
 (2013?和平区二模)我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐.
(2013?和平区二模)我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐. (2012?和平区一模)我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐.
(2012?和平区一模)我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐.

 我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐.
我们日常生活中,食用的食盐大多来自海水晾晒.海水经蒸发结晶后可获得含有少量泥沙和杂质的粗盐.

