题目内容
【题目】根据所学溶液知识,解答下列问题:
(1)如图是a、b、c三种固体物质(均不含结晶水)的溶解度曲线 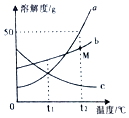
①t1℃a、b、c的溶解度大小关系是;
②t2℃将30克物质a加入到50克水中,形成溶液质量为克;
③t2℃时,将a、b、c三种物质的饱和溶液降温至t1℃时,仍为饱和溶液的是
④t2℃时,M点的a、b两种溶液质量分数大小关系为ab(填“大于”“小于”或“等于”)
(2)20℃时,将不同质量的NaCl晶体分别加入100g水中,充分溶解后所得溶液质量与加入NaCl晶体质量的对应关系如表:
组别 | A | B | C | D | E |
NaCl晶体质量/g | 5 | 15 | 20 | 30 | 40 |
所得溶液质量/g | 105 | 115 | X | 130 | 136 |
请回答下列问题:
①A组的溶液为(填“饱和”或“不饱和”)溶液.
②C组X的值为 .
【答案】
(1)b>a=c;75;a、b;等于
(2)不饱和;120g
【解析】解:(1)①通过分析溶解度曲线可知,t1℃,a、b、c的溶解度大小关系是:b>a=c;②t2℃时,a物质的溶解度是50g,将30克物质a加入到50克水中,50g的水只能溶解25g的溶质,所以形成溶液质量为75g;③a、b物质的溶解度随温度的升高而增大,c物质的溶解度随温度的升高而减小,所以t2℃时,将a、b、c三种物质的饱和溶液降温至t1℃时,仍为饱和溶液的是a、b;④t2℃时,M点的a、b两种溶液质量分数大小关系为a等于b;(2)①根据题意可知A组中还能继续溶解氯化钠固体,所以为不饱和溶液;②氯化钠的溶解度随温度的升高而增大,20℃时100g水中能溶解20g氯化钠,所以C组X的值为100+20=120.所以答案是:(1)①b>a=c;②75;③a、b;④等于;(2)①不饱和;②120.
【考点精析】解答此题的关键在于理解饱和溶液和不饱和溶液的相关知识,掌握饱和与不饱和的判断方法:看有无不溶物或继续加入该溶质,看能否溶解,以及对固体溶解度曲线及其作用的理解,了解1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).
