题目内容
【题目】(6分)一烧杯中盛有溶质质量分数为10%的CaCl2溶液,然后向烧杯中逐渐滴入溶质质量分数为10%的Na2CO3溶液至不再生成沉淀为止,过滤得到沉淀10g,将滤液蒸发掉90g水后,求所得溶液的溶质质量分数。
【答案】10%
【解析】
试题分析:利用化学方程式,根据反应的质量比即可计算出各物质的质量。
设生成的氯化钠的质量为x,参加反应的碳酸钠的质量为y,氯化钙的质量为z,那么:
Na2CO3+ CaCl2 === CaCO3↓+ 2NaCl
106 111 100 117
Y Z 10g X
![]()
![]()
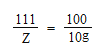
X = 11.7g Y = 10.6g Z = 11.1g
那么,参加反应的碳酸钠溶液的质量= 11.7 g ÷10%=117g
氯化钙溶液的质量=10.6 g÷10%=106g
反应后溶液的质量=117g+106g-10g=213g
蒸发掉90g水后溶液的质量=213g-90g=117g
那么所得溶液的质量分数=![]()
答: 略。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
【题目】(3分)氯化铵溶液在工农业生产中有着广泛的应用。
某同学向100g水中不断加入固体氯化铵或改变温度,得到相应的溶液①~⑤。
![]()
![]() ①
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤
资料:氯化铵的溶解度 | |||||
温度/℃ | 20 | 30 | 40 | 50 | 60 |
溶解度/g | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
试回答:
(1)氯化铵溶液中,溶质是_________。
(2)上述溶液①~⑤中,属于饱和溶液的是___________。[填序号]
(3)上述溶液①~⑤中,溶质质量分数最大的是_________。