题目内容
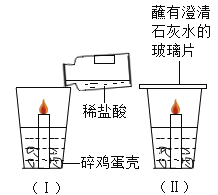
【题目】某研究小组为探究铁、铜、锌、银的金属活动性顺序,设计如下图所示的实验。(其中金属片均已用砂纸打磨过,其形状、大小及同种稀盐酸的用量均相同)
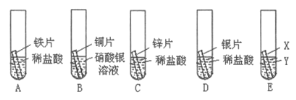
(1)看到A、C试管中有气泡产生,写出A试管中反应的方程式:____________________________。
(2)B试管中铜片表面有银白色固体附着,这说明铜比银的金属活动性______________(填“强”或“弱”)。
(3)甲同学认为通过实验可以得出锌的金属活动性比铁强,他依据的实验现象是__________。
(4)要想验证四种金属的活动性顺序,如果Y是硫酸铜溶液,则X是____________。
(5)经认真分析,它们认为上述有一个实验可以省略,该实验的序号是___________。
【答案】Fe+2HCl=FeCl2+H2↑ 强 锌片与稀盐酸的反应比铁片与稀盐酸的反应剧烈 Fe(或铁) D
【解析】
在金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸发生置换反应生成盐和氢气;排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来。
(1)铁和盐酸反应生成氯化亚铁和氢气,故A试管中反应的化学方程式为:Fe+2HCl=FeCl2+H2↑。
(2)B试管中铜片表面有银白色固体附着,是因为铜和硝酸银反应生成的银附着在了铜的表面,这说明铜比银的金属活动性强。
(3)甲同学认为通过实验可以得出锌的金属活动性比铁强,他依据的实验现象是锌片与稀盐酸的反应比铁片与稀盐酸的反应剧烈。
(4)对比A、C、D,可知铁、锌、银的活动性为:锌>铁>银,B试管中现象可知铜、银活动性为:铜>银,再比较铁和铜的活动性顺序即可知道四种金属的活动性顺序,如果Y是硫酸铜溶液,则X是铁片,铁和硫酸铜反应生成硫酸亚铁和铜,说明铁比铜活泼。
(5)上述实验D可以省略,这是因为通过B可知铜比银活泼,则银一定不能和盐酸反应。

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案