��Ŀ����
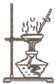
����Ŀ��ij��ȤС��Ϊ��̽����ʽ̼��ͭ[��ѧʽΪCu2��OH��2CO3]���Ⱥ�ֽ�IJ��ȡһ��������Ʒ���м��ȣ���ͼ1��ʾ����ּ��Ⱥ��Թܵײ����ɺ�ɫ���壬��ʹ����ʯ��ˮ����ǵ����壬�����Թܿڳ�����ɫҺ�壬˼���ش�
��1������������϶��������жϵ�������
��2����������⡿���ú�ɫ�������Ҫ�ɷ���ʲô��
���������ϡ�����ʽ̼��ͭ�ֽ�IJ����Ϊ�����
����������衿���ٿ���������ͭ���ڿ��������������
����Ϊ��������ȱ�����ݵ��ǣ����ţ� �������� ��
��3����ʵ����֤�������Թܿڵ���ɫҺ���ռ���������ͼ2���ˮ����ֱͨ���磬һ��ʱ��������븺�������������Ϊ1��2��������Ϊ����������Ϊ�������ʸ���ɫҺ��Ϊ ��
��4�����������ۡ��������������ݣ���д����ʽ̼��ͭ���ȷֽ�Ļ�ѧ����ʽ ��
���𰸡�
��1��CO2����������ʹ�����ʯ��ˮ����ǵ�����
��2���ڣ����������غ㶨�ɣ���Ӧǰ��Ԫ������䡢��Ӧǰ��ԭ������䣬��Ӧ����û����Ԫ��
��3��ˮ
��4��Cu2��OH��2CO3 ![]() 2CuO+CO2��+H2O
2CuO+CO2��+H2O
���������⣺��1���������̼��ʹ����ʯ��ˮ����ǣ�������Ϊ������̼����ѡCO2����������ʹ�����ʯ��ˮ����ǵ����壻��2���ڼ�ʽ̼��ͭ�в�������Ԫ�أ����ɫ����϶������������������أ����Դ��ǣ��ڣ����������غ㶨�ɣ���Ӧǰ��Ԫ������䡢��Ӧǰ��ԭ������䣬��Ӧ����û����Ԫ�أ���3��ʵ�������в���ȷ���Ƿ���ˮ���ɣ����Խ��Թܿڵ���ɫҺ���ռ���ֱͨ���磬һ��ʱ��������븺�������������Ϊ1��2��������Ϊ����������Ϊ������֤������ɫҺ��Ϊˮ�����Դ��ǣ�ˮ����4�������������ݿ�֪����ʽ̼��ͭ���ȷֽ����������CuO��CO2��H2O�����Դ��ǣ�Cu2��OH��2CO3 ![]() 2CuO+CO2��+H2O��
2CuO+CO2��+H2O��
�����㾫����ͨ��������õ��ˮʵ��������غ㶨�ɼ���Ӧ�ã����յ��ˮ��ʵ�飺A.װ�èD�D�Dˮ�����B.��Դ����---ֱ����C.����������������Ƶ�Ŀ��----��ǿˮ�ĵ�����D.��ѧ��Ӧ��2H2O=== 2H2��+ O2�����������غ㶨��ֻ�����ڻ�ѧ�仯���������������仯���ڲ��μӷ�Ӧ����������������������������������ܼ��롰�ܺ͡��У���Ҫ���ǿ����е������Ƿ�μӷ�Ӧ�����ʣ������壩������©�����Խ����⣮

 ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�