题目内容
 在实验室里,常用分解过氧化氢溶液、加热氯酸钾或高锰酸钾制取氧气.
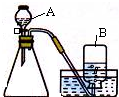
在实验室里,常用分解过氧化氢溶液、加热氯酸钾或高锰酸钾制取氧气.(1)选用如图所示的装置制取氧气,制取过程中所发生的化学反应方程式为:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(2)实验前先向仪器A中加入水,然后将导气管放入水槽中,并打开仪器A的活塞,观察导气管口是否有连续的气泡出现.该实验操作的目的是
检查装置的气密性
检查装置的气密性
.(3)实验证明,在过氧化氢溶液中滴加CuSO4溶液能显著加快过氧化氢的分解.CuSO4溶液主要含有三种粒子(H2O、Cu2+、SO42-),为了进一步探究CuSO4溶液中哪种粒子能起催化作用.作了以下分析和设计.
①你认为最不可能的是
H2O
H2O
,理由是双氧水中就含有水分子
双氧水中就含有水分子
.②要说明另外的两种粒子是否起到催化作用,设计了如下实验,完成了这次探究活动.
| 实验步骤 | 实验现象 | 结论 |
| a.取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴稀硫酸 | 溶液几乎没有气泡放出 | 实验证明,起催化作用的是 Cu2+ Cu2+ . |
| b.另取一支试管加入5mL5%过氧化氢溶液,然后加入2-3滴 硫酸铜 硫酸铜 溶液 |
溶液中有大量气泡放出 |
分析:(1)根据方程式书写注意事项考虑;
(2)根据检查装置气密性的方法分析.
(3)①根据双氧水中就含有水分子分析.
②根据步骤a中滴入稀硫酸中含有氢离子、硫酸根离子和水分子,溶液几乎没有气泡冒出;加入铜离子后产生气泡的速度较快分析.
③根据催化剂的概念分析.
(2)根据检查装置气密性的方法分析.
(3)①根据双氧水中就含有水分子分析.
②根据步骤a中滴入稀硫酸中含有氢离子、硫酸根离子和水分子,溶液几乎没有气泡冒出;加入铜离子后产生气泡的速度较快分析.
③根据催化剂的概念分析.
解答:解:(1)过氧化氢制氧气的反应物是过氧化氢,生成物是水和氧气,反应条件是二氧化锰作催化剂,用观察法配平,氧气后面标上上升符号;故答案:2H2O2
2H2O+O2↑.
(2)实验前先向仪器A中加入水,然后将导气管放入水槽中,并打开仪器A的活塞,观察导气管口是否有连续的气泡出现,说明装置气密性良好,故答案:检查装置的气密性.
(3)双氧水中就含有水分子,常温下双氧水分解产生氧气的速度很慢,故答案:H2O;双氧水中就含有水分子.
②步骤a中滴入稀硫酸中含有氢离子、硫酸根离子和水分子,溶液几乎没有气泡冒出可以证明不是硫酸根离子作双氧水制取氧气的催化剂;加入含铜离子的化合物后产生气泡的速度较快,可以证明起催化作用的是Cu2+.
故答案:硫酸铜;Cu2+
| ||
(2)实验前先向仪器A中加入水,然后将导气管放入水槽中,并打开仪器A的活塞,观察导气管口是否有连续的气泡出现,说明装置气密性良好,故答案:检查装置的气密性.
(3)双氧水中就含有水分子,常温下双氧水分解产生氧气的速度很慢,故答案:H2O;双氧水中就含有水分子.
②步骤a中滴入稀硫酸中含有氢离子、硫酸根离子和水分子,溶液几乎没有气泡冒出可以证明不是硫酸根离子作双氧水制取氧气的催化剂;加入含铜离子的化合物后产生气泡的速度较快,可以证明起催化作用的是Cu2+.
故答案:硫酸铜;Cu2+
点评:本题重在考查用双氧水制取氧气的操作和催化剂的催化作用,侧重能力考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 在实验室里,常用分解过氧化氢溶液、加热氯酸钾或高锰酸钾制取氧气.某化学兴趣小组对氧气的实验室制法进行了探究.
在实验室里,常用分解过氧化氢溶液、加热氯酸钾或高锰酸钾制取氧气.某化学兴趣小组对氧气的实验室制法进行了探究. (2012?南充)在实验室里,常用分解过氧化氢溶液、加热氯酸钾或高锰酸钾制取氧气.某化学兴趣小组对氧气的实验室制法进行了探究.
(2012?南充)在实验室里,常用分解过氧化氢溶液、加热氯酸钾或高锰酸钾制取氧气.某化学兴趣小组对氧气的实验室制法进行了探究.