题目内容
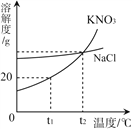
【题目】硝酸钾与氯化钾的溶解度曲线如图所示,回答下列问题:
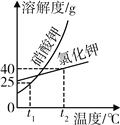
(1)t2 ℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是_______________的溶液。
(2)t2 ℃时,将25 g氯化钾加入盛有50 g水的烧杯中,充分溶解后,得到氯化钾溶液的质量是_______g。保持温度不变,往该烧杯中再加入5 g水,充分搅拌后,氯化钾溶液的溶质的质量分数:______(选填“变大”“不变”或“变小”)。
(3)当硝酸钾中混有少量氯化钾时,可用______________的方法提纯硝酸钾。
【答案】 硝酸钾 70 不变 降温结晶(或“冷却结晶”或“冷却热的饱和溶液”)
【解析】(1)t2℃降温至t1℃时,硝酸钾的溶解度质量差大于氯化钾的溶解度质量差,因此t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是硝酸钾的溶液;
(2)t2℃时,氯化钾的溶解度是40g,将50g水加入盛有25g氯化钾的烧杯中,充分溶解后,只能够溶解20g,得到氯化钾溶液的质量是70g;保持温度不变,往该烧杯中再加入5g水,充分搅拌后,又有2g溶解,仍然是饱和溶液,因此氯化钾溶液的溶质的质量分数不变;
(3)由溶解度曲线可知,的溶解度受温度变化影响较大,氯化钾的溶解度受温度变化影响较小,硝酸钾当硝酸钾中混有少量氯化钾时,可用降温结晶方法提纯硝酸钾。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目