题目内容
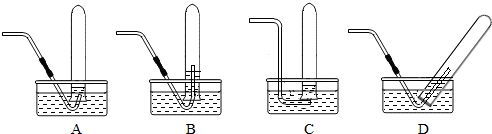
将下列操作与操作中试管位置正确的用直线将它们连接起来
【答案】分析:本题主要考查化学实验的基本操作,主要从操作要领上来分析.
解答:解:A、将块状固体放入试管中,要将试管横放,用镊子将块状固体放在试管口,再将试管慢慢竖起,所以选择②中试管放法;
B、向试管中倾倒液体时试管要倾斜,试剂瓶口与试管口紧挨着,所以选择③中试管的放法;
C、用胶头滴管向试管内滴加液体时,试管要竖直放,胶头滴管要垂悬在试管上方,所以选择⑤中试管的放法;
D、给试管内液体加热时,试管要倾斜与水平面呈45℃,增大试管的受热面积,所以选择④中试管的放法;
E、给试管中固体加热时,试管口要略向下倾斜,防止药品中的湿气加热变成水蒸气冷凝成水滴,倒流入试管底部,使试管炸裂,所以选择①中试管的放法.
故答案为:
点评:化学实验的基本操作是做好化学实验的基础,学生要在平时的练习中多操作,掌握操作要领,使操作规范.
解答:解:A、将块状固体放入试管中,要将试管横放,用镊子将块状固体放在试管口,再将试管慢慢竖起,所以选择②中试管放法;
B、向试管中倾倒液体时试管要倾斜,试剂瓶口与试管口紧挨着,所以选择③中试管的放法;
C、用胶头滴管向试管内滴加液体时,试管要竖直放,胶头滴管要垂悬在试管上方,所以选择⑤中试管的放法;
D、给试管内液体加热时,试管要倾斜与水平面呈45℃,增大试管的受热面积,所以选择④中试管的放法;
E、给试管中固体加热时,试管口要略向下倾斜,防止药品中的湿气加热变成水蒸气冷凝成水滴,倒流入试管底部,使试管炸裂,所以选择①中试管的放法.
故答案为:

点评:化学实验的基本操作是做好化学实验的基础,学生要在平时的练习中多操作,掌握操作要领,使操作规范.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
下列实验设计及操作,其现象足以说明结论的是
| | 操 作 | 现 象 | 结 论 |
| A | 在某氢氧化钠溶液样品中,加入足量的氯化钙溶液,过滤,在滤液中滴入2滴酚酞试液 | 出现白色沉淀, 酚酞不变红 | 该氢氧化钠溶液一定部分变质 |
| B | 将浓盐酸和大理石反应放出的气 体通入澄清石灰水 | 石灰水始 终未浑浊 | 该石灰水 一定变质 |
| C | 向滴有酚酞的稀氢氧化钠溶液的 试管中滴加一定量的稀盐酸 | 红色褪去 | 氢氧化钠与盐酸一定发生了反应 |
| D | 将充满二氧化碳气体的试管倒扣 在盛有氢氧化钠溶液的水槽中 | 试管内液 面上升 | 二氧化碳与氢氧化钠一定发生了反应 |
常温常压下1体积水约溶解1体积二氧化碳气体,氢氧化钠溶液与二氧化碳反应时没有明显的现象变化.某研究小组设计了下列实验装置 (所有装置的气密性良好),CO2都是用向上排空气法收集的.想通过观察现象来间接证明二氧化碳与氢氧化钠发生了反应.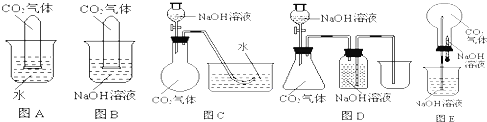
(1)请根据上图实验装置和下表的操作方法,将可能观察到的实验现象填入下表中:
| 所选 装置 | 操作方法 | 实验现象 |
| A | 将充满二氧化碳的试管倒扣在水中 | 试管内的液面略有上升 |
| B | 将充满二氧化碳的试管倒扣在氢氧化钠溶液中 | 试管内的液面明显上升 |
| C | 将氢氧化钠溶液滴入烧瓶 | |
| D | 将氢氧化钠溶液滴入锥形瓶 | |
| E | 将胶头滴管中氢氧化钠溶液挤入烧瓶 | 烧瓶内形成喷泉 |
(3)在实验中,同学们发现在操作过程完全正确的情况下,E装置中的液体都不可能充满整个烧瓶,你认为造成此现象的原因是:______.
下列实验设计及操作,其现象足以说明结论的是操作现象结论( )
A.A
B.B
C.C
D.D
| 操 作 | 现 象 | 结 论 | |
| A | 在某氢氧化钠溶液样品中,加入足量的氯化钙溶液,过滤,在滤液中滴入2滴酚酞试液 | 出现白色沉淀, 酚酞不变红 | 该氢氧化钠溶液一定部分变质 |
| B | 将浓盐酸和大理石反应放出的气 体通入澄清石灰水 | 石灰水始 终未浑浊 | 该石灰水 一定变质 |
| C | 向滴有酚酞的稀氢氧化钠溶液的 试管中滴加一定量的稀盐酸 | 红色褪去 | 氢氧化钠与盐酸一定发生了反应 |
| D | 将充满二氧化碳气体的试管倒扣 在盛有氢氧化钠溶液的水槽中 | 试管内液 面上升 | 二氧化碳与氢氧化钠一定发生了反应 |
A.A
B.B
C.C
D.D