题目内容
由硫元素和铜元素组成的一种化合物(硫化物)4.0g,高温条件下在空气中充分煅烧,只得到气体SO2和4.0g固体CuO.(1)要使煅烧后的固体产物CuO完全溶解.可加入适量稀硫酸.计算至少需要溶质质量分数为10%的稀硫酸多少克?(要求写出计算所需的化学方程式);
(2)运用所学知识和上述数据进行分析,这种硫化物的化学式为______.
【答案】分析:(1)可根据化学反应方程式的计算步骤和格式进行解答,但要注意化学方程式下的物质的质量必须是纯净物的质量.
(2)可根据SO2和CuO的质量求出硫元素和铜元素的质量,进而求出硫原子和铜原子的原子个数比,即可得到硫化物的化学式.
解答:解:(1)设质量为x的这种稀硫酸可与4.0gCuO恰好完全反应
CuO+H2SO4═CuSO4+H2O
80 98
4.0g 10%x
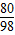 =
=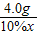
解之得 x=49g
答:完全溶解这些固体产物至少需要溶质质量分数为10%的稀硫酸49g.
(2)4.0gCuO中含铜为:4.0×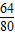 ×100%═3.2g,
×100%═3.2g,
则硫化物中硫元素的质量为:4.0g-3.2g═0.8g,
硫化物中硫元素与铜元素的质量比为 0.8:3.2═1:4,
硫化物的硫与铜的原子个数比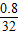 :
: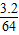 ═1:2,
═1:2,
故硫化物的化学式为:Cu2S.
故答案为:Cu2S
点评:本题有一定难度,注要考查学生根据化学方程式和化学式进行计算和推理的能力.
(2)可根据SO2和CuO的质量求出硫元素和铜元素的质量,进而求出硫原子和铜原子的原子个数比,即可得到硫化物的化学式.
解答:解:(1)设质量为x的这种稀硫酸可与4.0gCuO恰好完全反应
CuO+H2SO4═CuSO4+H2O
80 98
4.0g 10%x
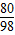 =
=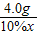
解之得 x=49g
答:完全溶解这些固体产物至少需要溶质质量分数为10%的稀硫酸49g.
(2)4.0gCuO中含铜为:4.0×
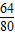 ×100%═3.2g,
×100%═3.2g,则硫化物中硫元素的质量为:4.0g-3.2g═0.8g,
硫化物中硫元素与铜元素的质量比为 0.8:3.2═1:4,
硫化物的硫与铜的原子个数比
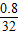 :
: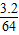 ═1:2,
═1:2,故硫化物的化学式为:Cu2S.
故答案为:Cu2S
点评:本题有一定难度,注要考查学生根据化学方程式和化学式进行计算和推理的能力.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目