题目内容
【题目】 从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料。请回答下列问题:
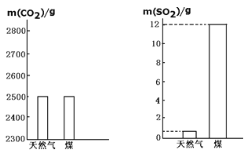
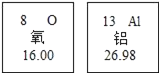
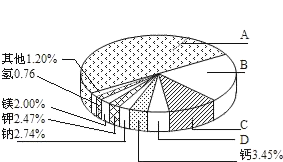
(1)地壳里各种元素的含量(质量分数)如图所示,其中表示硅元素的是_____(填字母)。
(2)根据元素周期表可知,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4,则常温下硅的化学性质_____(选填“活泼”、“不活泼”)。
(3)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法。生产过程示意如下:
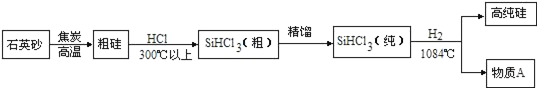
①整个制备过程必须达到无水无氧。在H2还原SiHCl3过程中若混入O2,可能引起的后果是_____。
②在生产过程中物质A可循环使用,A的化学式是_____;在生产过程中还有一种可循环使用的物质是_____。
【答案】B 不活泼 爆炸 HCl 氢气
【解析】
(1)地壳里各种元素的含量(质量分数)如图所示,由多到少的顺序是氧、硅、铝、铁、钙……,其中表示硅元素的是B;
(2)根据元素周期表可知,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4,常温下,碳的化学性质稳定,则常温下硅的化学性质不活泼;
(3)①整个制备过程必须达到无水无氧,因点燃或加热可燃性气体与氧气或空气的混合物易发生爆炸,在H2还原SiHCl3过程中若混入O2,可能引起的后果是爆炸;
②根据质量守恒定律可以知道粗硅和HCl反应,生成SiHCl3,同时还生成H2,而三氯甲烷和氢气反应生成了硅和氯化氢,即A为氯化氢,同时可以判定氯化氢和氢气可以循环利用。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案【题目】如图是一个具有刻度和活塞可滑动的玻璃容器,其中有空气和足量的白磷,将它放在盛有沸水的烧杯上方,进行实验。请完成实验报告:
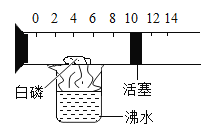
目的 | 实现象 | 实结论 |
测定空气中_____ 的体积分数 | 白着火火燃烧,先向_____移,后_____移,最后停在约为_____(填整数)的位置上. | 空的成分按体积算,_____约占1/5 |
【题目】硝酸钾和氯化钠在不同温度下的溶解度如下表,请回答。
温度/℃ | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 硝酸钾 | 31.6 | 63.9 | 110 | 169 | 246 |
氯化钠 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
(1)60℃时硝酸钾的溶解度是_____g。
(2)若硝酸钾中混有少量的氯化钠,提纯硝酸钾可以采取的方法是_____。
(3)20℃时,将硝酸钾和氯化钠两种固体各36g分别加入盛有100水的烧杯中,充分溶解后可观察到如图所示的现象。
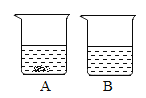
①烧杯A中溶解的物质是_____。
②若向烧杯A中加入一定量的水使剩余固体刚好全部溶解变为饱和溶液,则溶液中溶质的质量分数_____(填“变大”、“变小”或“不变”)。
③若将A、B烧杯中的物质同时升温至80℃,则A、B中溶质的质量_____(填“一定”或“不一定”)相等。
【题目】下列对实验现象的解释不正确的是( )
选项 | 实验现象 | 解释 |
A | 向硬水中滴加肥皂水会产生浮渣 | 硬水中含有较多的可溶性钙、镁化合物 |
B | 向铁粉中滴加稀盐酸有气泡产生 | 盐酸易挥发 |
C | 向某无色溶液中滴入 | 该溶液中一定含有碳酸盐 |
D | 向某氮肥中加入碱并研磨会产生氨味 | 铵盐与碱反应放出氨气 |
A. AB. BC. CD. D