题目内容
下列物质俗称与化学式相对应的是( )
A. 干冰——H2O B. 纯碱——NaOH C. 消石灰——CaO D. 苏打——Na2CO3
生石灰常用作食品干燥剂,干燥剂包装袋上除了标明主要成分为生石灰外,还提醒人们注意:不可食用、不可浸水、不可开袋、不可玩耍、儿童勿取。
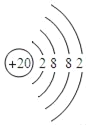
(1)如图是钙的原子结构示意图,下列说法不正确的是_____。
A 钙属于金属元素 B 钙原子的质子数为20
C 钙离子的符号为Ca2﹣ D 钙在化学反应中易失去电子
(2)同学们将一袋干燥剂倒入一定量的水中,发现生石灰开始“沸腾”,咕嘟咕嘟冒泡,不时有白色水蒸气冒出,充分搅拌后过滤,得到白色沉淀和滤液。通过实验现象可知生石灰遇水后会_____(选填“放热”或“吸热”)。生石灰干燥剂不可浸水的原因是_____(用化学方程式表示)
(3)同学们想知道所得白色沉淀的成分,进行了如下探究:
(提出问题)白色沉淀中含有哪些物质?
(猜想假设)猜想1:只含有氢氧化钙;猜想2:只含碳酸钙;猜想3:含有氢氧化钙和碳酸钙。
(活动探究)同学们进行了如表所示的实验,请将下表填写完整。
实验步骤 | 现象 | 解释 |
取少量样品于试管中,加入足量的稀盐酸 | 有气泡产生 | 化学方程式:_____ |
取少量样品于试管中,加入适量水,充分搅拌后,再滴加几滴无色酚酞溶液 | 呈_____色 | _____ |
(结论)猜想_____合理。
(4)工业上用高温煅烧石灰石的方法来制取生石灰,若用该方法制取11.2kg氧化钙,理论上至少需要含80%碳酸钙的石灰石的质量是多少_____?
实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
[定性探究]
(1)称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含_____。
(2)取(1)中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
操作 | 现象 | 结论 |
①向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有_____ |
②取①中上层清液,滴加_____ | _____ | 原固体中不含NaOH |
其中,步骤①加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是_____。
(3)再取(1)中得到的滤液少量,进行如图1所示操作:
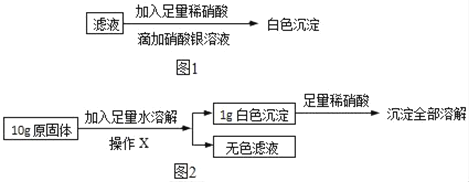
同学们认为:原固体中一定含有NaCl.但是老师指出这个结论不正确,其理由是_____(填序号)。
A 滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B 滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
[定量探究]
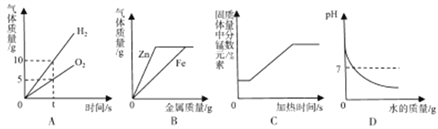
(4)在老师的指导下同学们又精确称量了10g原固体,进行如图2实验:
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是_____,则原固体中一定不含_____;其中,操作X的名称是_____,无色滤液中一定含有的阳离子是_____。根据生成沉淀的质量计算原固体中氯化钙的质量分数是_____。


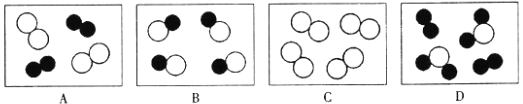
 ”和“
”和“ ”表示不同元素的原子,下列微观示意图能表示化合物的是( )
”表示不同元素的原子,下列微观示意图能表示化合物的是( )