题目内容
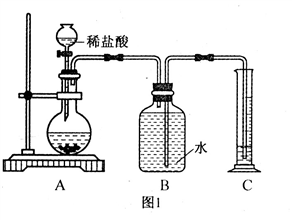
如图1和图2所示装置分别制取适量O2和CO2气体.请回答下列问题: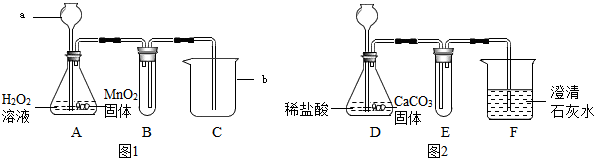
(1)指出编号仪器的名称:a
(2)A中MnO2的作用是
(3)写出A、D中发生反应的化学方程式,A
(4)按实验要求完成下表内容(不需要的可以不填)F装置中发生反应的化学方程式为

(1)指出编号仪器的名称:a
长颈漏斗
长颈漏斗
;b烧杯
烧杯
(2)A中MnO2的作用是
加快过氧化氢的分解速率
加快过氧化氢的分解速率
(3)写出A、D中发生反应的化学方程式,A
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;D
| ||
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.(4)按实验要求完成下表内容(不需要的可以不填)F装置中发生反应的化学方程式为
CO2+Ca(OH)2=CaCO3↓+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
.| 制取气体 | 应加入的物质 | 物质或装置所起的作用 | |
| O2 | B | 水 水 |
排水收集氧气 排水收集氧气 |
| C | 接收B中排出的水 接收B中排出的水 | ||
| CO2 | E | 收集二氧化碳 收集二氧化碳 | |
| F | 澄清石灰水 | 验证二氧化碳的性质 验证二氧化碳的性质 | |
分析:(1)要熟悉各种仪器的名称、用途和使用方法;
(2)二氧化锰可以用作过氧化氢分解的催化剂;
(3)过氧化氢在二氧化锰的催化作用下,分解生成水和氧气,碳酸钙和稀盐酸反应能生成氯化钙、水和二氧化碳;
(4)二氧化碳能使澄清的石灰水变浑浊;
利用排水法、向上排空气法可以收集氧气,利用向上排空气法可以收集二氧化碳.
(2)二氧化锰可以用作过氧化氢分解的催化剂;
(3)过氧化氢在二氧化锰的催化作用下,分解生成水和氧气,碳酸钙和稀盐酸反应能生成氯化钙、水和二氧化碳;
(4)二氧化碳能使澄清的石灰水变浑浊;
利用排水法、向上排空气法可以收集氧气,利用向上排空气法可以收集二氧化碳.
解答:解:(1)a是长颈漏斗,通过长颈漏斗可以向锥形瓶中注入液体;b是烧杯,烧杯可以用作反应容器,可以配制溶液,可以用于过滤等.
故填:长颈漏斗;烧杯.
(2)A中二氧化锰的作用是加快过氧化氢的分解速率.
故填:加快过氧化氢的分解速率.
(3)过氧化氢在二氧化锰的催化作用下分解的化学方程式为:2H2O2
2H2O+O2↑;
碳酸钙和稀盐酸反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑.
故填:2H2O2
2H2O+O2↑;CaCO3+2HCl=CaCl2+H2O+CO2↑.
(4)二氧化碳进入F装置中时,能和石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O.
故填:CO2+Ca(OH)2=CaCO3↓+H2O.
氧气不易溶于水,可以用排水法收集,所以B中应该加入水,B装置所起的作用是利用排水法收集氧气,C装置的作用是接收B中排出的水;
E装置的作用是利用向上排空气法收集二氧化碳,F装置的作用是验证二氧化碳的性质,即二氧化碳能使石灰水变浑浊;
应加入的物质、物质或装置所起的作用如表中所示:
故填:长颈漏斗;烧杯.
(2)A中二氧化锰的作用是加快过氧化氢的分解速率.
故填:加快过氧化氢的分解速率.
(3)过氧化氢在二氧化锰的催化作用下分解的化学方程式为:2H2O2
| ||
碳酸钙和稀盐酸反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑.
故填:2H2O2
| ||
(4)二氧化碳进入F装置中时,能和石灰水中的氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O.
故填:CO2+Ca(OH)2=CaCO3↓+H2O.
氧气不易溶于水,可以用排水法收集,所以B中应该加入水,B装置所起的作用是利用排水法收集氧气,C装置的作用是接收B中排出的水;
E装置的作用是利用向上排空气法收集二氧化碳,F装置的作用是验证二氧化碳的性质,即二氧化碳能使石灰水变浑浊;
应加入的物质、物质或装置所起的作用如表中所示:
| 制取气体 | 应加入的物质 | 物质或装置所起的作用 | |
| O2 | B | 水 | 排水收集氧气 |
| C | 接收B中排出的水 | ||
| CO2 | E | 收集二氧化碳 | |
| F | 澄清石灰水 | 验证二氧化碳的性质 | |
点评:本题主要考查仪器的用途、催化剂的作用和化学方程式的书写,书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.

练习册系列答案
相关题目