题目内容
工业用碳酸钠溶液与石灰水反应制烧碱。对于碳酸钠溶液与石灰水是否恰好完全反应,化学小组同学将其产物进行过滤,并对滤液进行如下探究。
提出假设:假设一:滤液中只含氢氧化钠
假设二:滤液中含氢氧化钠和氢氧化钙
假设三:滤液中含氢氧化钠和碳![]() 酸钠
酸钠
假设四:滤液中含氢氧化钠、氢氧化钙和碳酸钠[来源:Zxxk.Com]
甲同学设计了如下实验方案:已知:Na2CO3 + CaCl2= 2NaCl+CaCO3↓(白色)
| 实验步骤 | 实验现象 | 结论 |
| 取少量滤液放在试管中,再滴入氯化钙溶液 | 若生成白色沉淀[来源:学科网] | 碳酸钠过量[来源:学科网ZXXK][来源:学科网][来源:学|科|网Z|X|X|K][来源:Z.xx.k.Com][来源:Z§xx§k.Com] |
| 若无明显现象 | 恰好反应 |
试回答:
(1)写出碳酸钠溶液与石灰水反应的化学方程式 。
(2)哪种假设不合理,试说明理由 。
(3)乙同学认为甲同学设计方案还不能说明碳酸钠溶液和澄清石灰水恰好完全反应,她的理由
是 。
(4)丙同学认为要说明碳酸钠溶液与石灰水是否恰好完全反应,还需在甲同学实验方案的基础
上进行实验。她的实验方案是:
| 实验步骤 | 实验现象和结论 |
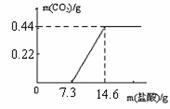
(5)取18.6g氢氧化钠样品(样品中的杂质是碳酸钠),加水溶解得到溶液A,取A溶液的1/10向其中逐滴加入一定浓度的稀盐酸,并同时记录放出CO2的质量和消耗盐酸的质量(所得数据如右图)。试计算:
①盐酸中溶质的质量分数为 。
②样品中碳元素的质量分数为 。
(1)Na2CO3+Ca(OH)2==== CaCO3↓+2NaOH
(2)假设四不合理,因为氢氧化钙溶液与碳酸钠溶液不能共存。
(3)若氢氧化钙过量与氯化钙不发生反应
(4)
| 实 验 步 骤 | 实 验 现 象 和 结 论 |
| 取甲同学实验后的清液放在试管中,在通入足量的二氧化碳(或滴入Na2CO3溶液),观察 | 溶液无变化,则不含氢氧化钙 |
| 溶液变浑浊,则含氢氧化钙 |
(5)10% 6.5%

.(10分)2011年9月,某牙膏被曝含有致癌物“三氯生”而引起消费者的焦虑,于是同学们开展了对牙膏成分及作用的探究,经过查阅资料得知:
(1)很多品牌牙膏都标有“含氟”字样,其中的“氟”是指
A.氟单质 B.氟元素 C.氟原子
(2)牙膏去污主要是利用了摩擦作用。某品牌牙膏中的摩擦剂是碳酸钙,为了检验并测定牙膏中碳酸钙的质量分数,同学们取了10g牙膏,加入足量稀盐酸并搅拌。实验过程中记录并处理数据形成下图曲线:

该品牌牙膏中碳酸钙的质量分数为多少。
(3)用作牙膏摩擦剂的轻质碳酸钙可以石灰石来制备,工业上主要生产流程如下:

①“煅烧炉”中发生反应的化学方程式是: ,在“反应池”中主要发生反应的化学方程式是: 。
②“沉淀池”中生石灰与水充分反应后可得到颗粒非常细小的熟石灰浆,熟石灰浆为
(选填“悬浊液”或“溶液”或“乳浊液”)。
③有人建议在上述流程中用CO2替代“碳酸钠溶液”。这样做的优点是 。
小王查阅资料后得知:a.二氧化碳持续通入氢氧化钙溶液发生如下反应: CO2+Ca(OH)2=CaCO3↓+H2O, CaCO3+ H2O + CO2=Ca(HCO3)2;
|
为了防止利用该法制得的轻质碳酸钙中混有Ca(HCO3)2,操作2中必需要进行的一步操作是 。
【解析】(1)运用物质是由元素组成的,“含氟”字样,其中的“氟”是指氟元素解答.
(2)由图可知碳酸钙和盐酸完全反应后生成的二氧化碳质量为1.32g,根据化学方程式列比例式求出碳酸钙的质量,进行解答
(3)煅烧炉中主要发生的是碳酸钙在高温下分解为氧化钙和二氧化碳的反应,根据化学方程式的书写规则正确书写;
沉淀池中主要发生的是氧化钙与水反应生成氢氧化钙的反应,根据化学方程式的书写规则正确书写;
根据悬浊液和乳浊液的定义进行分析回答;
用二氧化碳代替碳酸钠溶液,可达到降低生产成本和节能减排;