题目内容
【题目】工业制取碳酸钠常会含有少量的氯化钠.实验探究小组欲测定碳酸钠样品中碳酸钠的质量分数,取该样品11g加入64.4g水形成不饱和溶液,然后向其中加入一定量的稀盐酸,恰好完全反应,所得溶液的溶质质量分数10%.产生二氧化碳的质量与时间的关系如图所示:
(1)求该样品中碳酸钠的质量分数.(结果精确到0.1%)
(2)求恰好完全反应时所加稀盐酸的质量.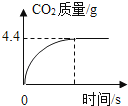
【答案】解:(1)设碳酸钠的质量为x,生成氯化钠的质量为y,
由图中数据可知,生成二氧化碳的质量是4.4g,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
106 117 44
x y 4.4g![]() ,
,
x=10.6g,y=11.7g,
该样品中碳酸钠的质量分数为:![]() ×100%=96.4%,
×100%=96.4%,
答:该样品中碳酸钠的质量分数为96.4%.
(2)恰好完全反应时所加稀盐酸的质量为:![]() +4.4g﹣11g﹣64.4g=50g,
+4.4g﹣11g﹣64.4g=50g,
答:恰好完全反应时所加稀盐酸的质量为50g.
【解析】解:(1)设碳酸钠的质量为x,生成氯化钠的质量为y,
由图中数据可知,生成二氧化碳的质量是4.4g,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
106 117 44
x y 4.4g![]() ,
,
x=10.6g,y=11.7g,
该样品中碳酸钠的质量分数为:![]() ×100%=96.4%,
×100%=96.4%,
答:该样品中碳酸钠的质量分数为96.4%.
(2)恰好完全反应时所加稀盐酸的质量为:![]() +4.4g﹣11g﹣64.4g=50g,
+4.4g﹣11g﹣64.4g=50g,
答:恰好完全反应时所加稀盐酸的质量为50g.
【考点精析】根据题目的已知条件,利用溶质的质量分数和根据化学反应方程式的计算的相关知识可以得到问题的答案,需要掌握溶质的质量分数=(溶质质量/溶液质量)*100% = [溶质质量/(溶质质量+溶剂质量]*100%;各物质间质量比=系数×相对分子质量之比.

 阅读快车系列答案
阅读快车系列答案