题目内容
向20mL1mol/L的Al2(SO4)3溶液中加入30mLKOH溶液充分反应后得到0.78g沉淀,则KOH溶液的物质的量浓度为
- A.1mol/L
- B.3mol/L
- C.5mol/L
- D.7mol/L
AC
分析:根据Al2(SO4)3溶液与KOH溶液的反应计算分析,20mL1mol/LAl2(SO4)3全转化为沉淀的质量为:0.02L×2mol/L×78g/mol=3.12g,根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知KOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,以此计算.
解答:20mL1mol/LAl2(SO4)3完全转化为沉淀的质量为0.02L×2mol/L×78g/mol=3.12g,
根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知KOH存在两种情况,一是不足,
二是使Al(OH)3部分溶解,
设KOH的浓度为c,当KOH不足时,
Al3++3OH-=Al(OH)3↓
3mol 78g
0.03L×c 0.78g
c= =1mol/L,
=1mol/L,
当KOH使Al(OH)3部分溶解时,设KOH的物质的量为x,根据反应:
Al3++3OH-=Al(OH)3↓
1mol 3mol 78g
0.04mol 0.12mol 3.12g
Al(OH)3+OH-=AlO2-+H2O
78g 1mol
(3.12-0.78)g (x-0.12mol)
x=0.15mol,
则KOH的物质的量浓度为:c=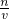 =
= =5mol/L,
=5mol/L,
由上述分析计算可知,KOH溶液的物质的量浓度为1mol/L或5mol/L,所以AC正确,BD错误.
故选AC.
点评:本题考查物质的量浓度的计算,题目难度中等,注意判断氯化铝反应的程度,为解答本题的关键,用讨论法解答.
分析:根据Al2(SO4)3溶液与KOH溶液的反应计算分析,20mL1mol/LAl2(SO4)3全转化为沉淀的质量为:0.02L×2mol/L×78g/mol=3.12g,根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知KOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,以此计算.
解答:20mL1mol/LAl2(SO4)3完全转化为沉淀的质量为0.02L×2mol/L×78g/mol=3.12g,
根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知KOH存在两种情况,一是不足,
二是使Al(OH)3部分溶解,
设KOH的浓度为c,当KOH不足时,
Al3++3OH-=Al(OH)3↓
3mol 78g
0.03L×c 0.78g
c=
 =1mol/L,
=1mol/L,当KOH使Al(OH)3部分溶解时,设KOH的物质的量为x,根据反应:
Al3++3OH-=Al(OH)3↓
1mol 3mol 78g
0.04mol 0.12mol 3.12g
Al(OH)3+OH-=AlO2-+H2O
78g 1mol
(3.12-0.78)g (x-0.12mol)
x=0.15mol,
则KOH的物质的量浓度为:c=
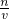 =
= =5mol/L,
=5mol/L,由上述分析计算可知,KOH溶液的物质的量浓度为1mol/L或5mol/L,所以AC正确,BD错误.
故选AC.
点评:本题考查物质的量浓度的计算,题目难度中等,注意判断氯化铝反应的程度,为解答本题的关键,用讨论法解答.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目