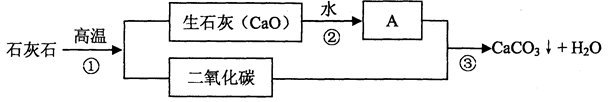
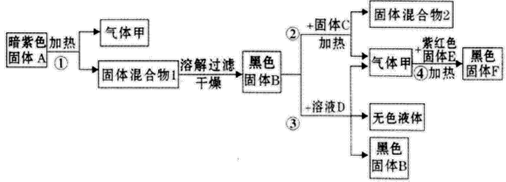
题目内容
(2011年重庆綦江,21题)某粗盐提纯后得到的“精盐”中还含有少量可溶性杂质CaCl2、MgCl2,小青同学设计了以下实验方案来除去可溶性杂质。
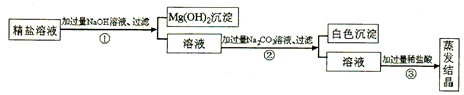
步骤①的化学方程式为_______________________________________。
步骤②中得到的白色沉淀是_________________________ (填化学式)
步骤③中加稀盐酸是为了除去溶液中的___________________。

步骤①的化学方程式为_______________________________________。
步骤②中得到的白色沉淀是_________________________ (填化学式)
步骤③中加稀盐酸是为了除去溶液中的___________________。
| A.CaCl2 | B.MgCl2 | C.NaOH | D.Na2CO3 |
(l)2NaOH+MgCl2====2NaCl+Mg(OH)2↓(2)CaCO3(3)C D
本题考查的是氯化钠与粗盐提纯,物质除杂或净化的探究,书写化学方程式。本实验的过程为:
①加过量NaOH溶液,与MgCl2发生反应,生成Mg(OH)2沉淀和氯化钠,故化学方程式为2NaOH+MgCl2====2NaCl+Mg(OH)2↓;
②加过量Na2CO3溶液,与CaCl2发生反应,生成CaCO3沉淀和氯化钠,过滤,滤出前面生成的沉淀,即CaCO3;
③加适量盐酸,是为了与①中过量NaOH溶液和②中过量Na2CO3溶液发生反应,生成氯化钠、水和二氧化碳气体;蒸发、结晶,得到精盐。
点评:除钙离子用碳酸根,除镁离子用氢氧根,因为加入的试剂都是过量的,所以后加的试剂要把先加的试剂所带入的杂质除掉,加入过量的稀盐酸,这样可以除去多余的碳酸根离子和氢氧根离子。
①加过量NaOH溶液,与MgCl2发生反应,生成Mg(OH)2沉淀和氯化钠,故化学方程式为2NaOH+MgCl2====2NaCl+Mg(OH)2↓;
②加过量Na2CO3溶液,与CaCl2发生反应,生成CaCO3沉淀和氯化钠,过滤,滤出前面生成的沉淀,即CaCO3;
③加适量盐酸,是为了与①中过量NaOH溶液和②中过量Na2CO3溶液发生反应,生成氯化钠、水和二氧化碳气体;蒸发、结晶,得到精盐。
点评:除钙离子用碳酸根,除镁离子用氢氧根,因为加入的试剂都是过量的,所以后加的试剂要把先加的试剂所带入的杂质除掉,加入过量的稀盐酸,这样可以除去多余的碳酸根离子和氢氧根离子。

练习册系列答案
相关题目