题目内容
下列有关水的叙述错误的是( )
A. 水电解时正极产生氧气
B. 水的天然循环是通过其三态变化实现的
C. 水变成水蒸气,水分子大小不变
D. 天然水经过自来水厂净化后得到的水是纯净物
某兴趣小组同学对实验室制备氧气的条件进行如下探究。
(提出问题)①氧化铜是否也能做氯酸钾分解的催化剂?它是否比二氧化锰催化效果好?
(查阅资料)研究表明,许多金属氧化物对氯酸钾的分解有催化作用。分别用下列金属氧化物作催化剂,氯酸钾开始发生分解反应和反应剧烈时的温度如下表所示:
种类 | 氧化铁 | 氧化铝 | 氧化铜 | 氧化镁 |
开始反应 | 420℃ | 515℃ | 305℃ | 490℃ |
剧烈反应 | 490℃ | 540℃ | 350℃ | 545℃ |
实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用的金属氧化物是__________。
(设计并完成实验)
Ⅰ. 将3.0g氯酸钾放在试管中加热
Ⅱ. 将3.0g氯酸钾与1.0g二氧化锰均匀混合加热
Ⅲ. 将3.0g氯酸钾与Xg氧化铜均匀混合加热
(实验现象分析)
Ⅲ中X的值应为____________,实验Ⅰ和Ⅲ比较可证明___________________。实验Ⅱ和Ⅲ对比的目的是_____________________。将实验Ⅲ反应后的固体加水溶解、_________、洗涤、干燥,然后进行称量的目的是________,最后还要再将黑色粉末和_________混合加热,
(结论)氧化铜也能作氯酸钾分解的催化剂,实验Ⅲ中的化学反应的化学方程式为________________。
(实验反思)MnO2的用量对 H2O2分解反应有何影响?
(设计并完成实验)利用图甲装置探究“MnO2的用量对 H2O2分解反应的影响”,实验中为3%H2O2溶液,装置中产生氧气的量可以用压强传感器测出(在等温条件下,产生氧气体积与装置内压强成正比,反应放热忽略不计。)

(讨论交流)(1)图乙是“0.1克MnO2与不同体积的3%H2O2溶液混合”的实验结果,从图中可以看出_________________。
⑵图丙是“不同质量的MnO2与相同体积的3%H2O2溶液混合”的实验结果,从图中可以看出___________________。
碳酸氢钠是小苏打的主要成分,在生产和生活中有许多重要的用途。
(学生实验)化学课上,同学们为了解碳酸氢钠的性质,将一定质量的碳酸氢钠和稀硫酸混合,充分反应后,有气泡逸出,写出该反应的化学方程式_____。同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外可能还含有其他成分,因此进行了猜想并做了如下实验。
(实验用品)pH试纸、锌片、氧化铜粉末、稀硫酸、氢氧化钠溶液、氯化钡溶液。
(猜想与假设)反应后溶液中溶质的组成成分可能有哪些?
猜想一:硫酸钠;猜想二:硫酸钠、碳酸氢钠;猜想三:硫酸钠、硫酸。
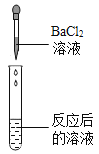
(实验探究)同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成下表。
实验方案 | A | B | C | D |
实验操作 |
|
|
| |
实验现象 | _____ | 产生白色沉淀 | 试纸变色,对照标准比色卡,pH<7 | |
实验结论 | 猜想二不正确 | 猜想三正确 | 猜想三正确 | 猜想三正确 |
(得出结论)猜想三正确。
(评价反思)(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予肯定,同时指出探究中存在一处明显错误操作是_____。
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由_____。
(总结提高)依据所给实验用品,请你设计方案D(实验操作、实验现象)确认猜想三是正确的_____。