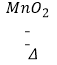题目内容
【题目】某实验小组为测定一氯酸钾样品的纯度,取一定质量的该样品与1g二氧化锰混合,其总质量为6g.待加热到不再产生气体,冷却后称量剩余固体质量为4.08g.请计算:
(1)产生氧气的质量;
(2)样品中氯酸钾的质量分数?
【答案】
(1)解:根据质量守恒定律,至固体质量不再减小,放出氧气的质量=6g﹣4.08g=1.92g
(2)解:设样品中含有氯酸钾的质量为x
2KClO3 |
| 2KCl | + | 3O2↑ |
245 | 96 | |||
x | 1.92g |
![]()
x=4.9g
,样品中氯酸钾的纯度= ![]() ×100%=98%
×100%=98%
【解析】(1)根据质量守恒定律,在反应剩余固体不再减小时,与原固体的质量差即为放出氧气的质量;(2)根据反应的化学方程式,由放出氧气的质量计算出样品中氯酸钾的质量,再利用纯度公式计算该样品中氯酸钾的纯度.
【考点精析】认真审题,首先需要了解根据化学反应方程式的计算(各物质间质量比=系数×相对分子质量之比).

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目