题目内容
小强从家里带来的一包纯碱样品进行实验:
查阅资料:①纯碱中含有少量的氯化钠、碳酸氢钠;②碳酸氢钠晶体加热分解后即可得到纯碱:2NaHCO3 Na2CO3+CO2↑+H2O;③NaHCO3+HCl═NaCl+CO2↑+H2O;④少量的NaHCO3与Ca(OH)2反应:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
Na2CO3+CO2↑+H2O;③NaHCO3+HCl═NaCl+CO2↑+H2O;④少量的NaHCO3与Ca(OH)2反应:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
请你一起完成以下探究活动:
[对固体猜想]纯碱样品中一定有氯化钠、碳酸氢钠
[实验和推断]
(1)将固体充分加热有气体产生,产生的是________气体,推断含有少量的碳酸氢钠;
(2)将实验(1)得到的固体取样,若A是CaCl2溶液,B为试液为AgNO3溶液,实验现象a为________,现象b为________,能不能说明原样品中含有氯化钠________(填能或不能).
(3)小强在老师指导下,将样品提纯,并且制造出氢氧化钠的溶液.生成氢氧化钠的化学方程式为________.
(4)小强用下列图象表示盐酸和氢氧化钠溶液发生反应过程中溶液的pH变化.请从图象中获取信息,回答下列问题:
①进行该反应的实验操作是按照以上________(填“甲”或“乙”)图所示进行;
②pH=7时,共得溶液100g.已知盐酸溶质的质量分数为18.25%,求所得溶液中溶质的质量分数.(要写计算过程)
解:(1)碳酸氢钠在加热的条件下反应生成二氧化碳、碳酸钠和水,故产生的气体是二氧化碳,推断含有少量的碳酸氢钠;
(2)若A是CaCl2溶液会与纯碱反应生成碳酸钙白色沉淀和氯化钠,故实验现象a为产生白色沉淀;
若B为试液为AgNO3溶液,会与氯化钠反应生成白色的氯化银沉淀;
因为CaCl2溶液会与纯碱反应生成碳酸钙白色沉淀和氯化钠,故现象b不能说明原样品中含有氯化钠;
(3)碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═2NaOH+CaCO3↓;
(4)①根据PH值的图象的变化趋势,可以看出,pH值是由大于7逐渐的减小到7,可以得出原溶液是碱性的,加酸进行中和反应,变成中性,故答案为:乙;
②由题意可知,参加反应的盐酸溶液质量为20g,其中参加反应的氯化氢的质量为:20g×18.25%=3.65g;
设与3.65g氯化氢反应生成氯化钠的质量为x
NaOH+HCl=NaCl+H2O
36.5 58.5
3.65g x
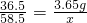
解得x=5.85g
故所得溶液的溶质的质量分数为: ×100%=5.85%
×100%=5.85%
答:所得溶液的溶质的质量分数为5.85%.
故答案为:(1)二氧化碳;(2)产生白色沉淀;产生白色沉淀;不能;(3)Na2CO3+Ca(OH)2═2NaOH+CaCO3↓;(4)①乙;②5.85%;
分析:(1)根据碳酸氢钠受热分解放出二氧化碳进行解答;
(2)根据CaCl2溶液会与纯碱反应生成碳酸钙白色沉淀和氯化钠,AgNO3溶液会与氯化钠反应生成白色的氯化银沉淀进行解答;
(3)根据碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠和化学方程式的书写规则进行解答;
(4)①根据pH值是由大于7逐渐的减小到7进行解答;
②根据图象中所用盐酸的质量和盐酸的质量分数,通过化学方程式计算生成的氯化钠的质量,然后根据溶质的质量分数= ×100%进行解答;
×100%进行解答;
点评:本题主要考查了根据图象对中和反应的正确的判断和理解,难度不大,综合性强.
(2)若A是CaCl2溶液会与纯碱反应生成碳酸钙白色沉淀和氯化钠,故实验现象a为产生白色沉淀;
若B为试液为AgNO3溶液,会与氯化钠反应生成白色的氯化银沉淀;
因为CaCl2溶液会与纯碱反应生成碳酸钙白色沉淀和氯化钠,故现象b不能说明原样品中含有氯化钠;
(3)碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Na2CO3+Ca(OH)2═2NaOH+CaCO3↓;
(4)①根据PH值的图象的变化趋势,可以看出,pH值是由大于7逐渐的减小到7,可以得出原溶液是碱性的,加酸进行中和反应,变成中性,故答案为:乙;
②由题意可知,参加反应的盐酸溶液质量为20g,其中参加反应的氯化氢的质量为:20g×18.25%=3.65g;
设与3.65g氯化氢反应生成氯化钠的质量为x
NaOH+HCl=NaCl+H2O
36.5 58.5
3.65g x
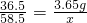
解得x=5.85g
故所得溶液的溶质的质量分数为:
 ×100%=5.85%
×100%=5.85%答:所得溶液的溶质的质量分数为5.85%.
故答案为:(1)二氧化碳;(2)产生白色沉淀;产生白色沉淀;不能;(3)Na2CO3+Ca(OH)2═2NaOH+CaCO3↓;(4)①乙;②5.85%;
分析:(1)根据碳酸氢钠受热分解放出二氧化碳进行解答;
(2)根据CaCl2溶液会与纯碱反应生成碳酸钙白色沉淀和氯化钠,AgNO3溶液会与氯化钠反应生成白色的氯化银沉淀进行解答;
(3)根据碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠和化学方程式的书写规则进行解答;
(4)①根据pH值是由大于7逐渐的减小到7进行解答;
②根据图象中所用盐酸的质量和盐酸的质量分数,通过化学方程式计算生成的氯化钠的质量,然后根据溶质的质量分数=
 ×100%进行解答;
×100%进行解答;点评:本题主要考查了根据图象对中和反应的正确的判断和理解,难度不大,综合性强.

练习册系列答案
相关题目
星期天,小强的妈妈要焙制面包,叫小强去商店买回一包纯碱,小强仔细看了包装说明(如图),并产生疑问:纯碱样品中碳酸钠的质量分数是否达标呢?

回到学校,他取出从家里带来的一小包纯碱样品和小明一起进行实验,小明和小强分别设计了以下两种不同的实验方案:
(1)小强测得的纯碱样品中碳酸钠的质量分数是多少?(写出计算过程)
(2)小明测得的纯碱样品中碳酸钠的质量分数是多少?(写出计算过程)
(3)两位同学又请来老师帮忙,老师选取另外一种测定方法经反复测定结果都是96.3%,请你结合实验过程分析一下两位同学谁的测定结果不准确,为什么?

回到学校,他取出从家里带来的一小包纯碱样品和小明一起进行实验,小明和小强分别设计了以下两种不同的实验方案:
| 实验方案 | |
| 小强 | 准确称取5.5g纯碱样品放入烧杯中,又取来50克、14.6%的稀盐酸逐滴加入,至刚好不再产生气泡停止滴加稀盐酸,还剩余稀盐酸25克. |
| 小明 | 准确称取5.5g纯碱样品放入锥形瓶中,加入一定质量分数、足量的稀盐酸,并将产生的气体干燥后通入足量的氢氧化钠溶液中(如图所示),充分吸收后,称量氢氧化钠溶液质量增加了2.0克. |
(2)小明测得的纯碱样品中碳酸钠的质量分数是多少?(写出计算过程)
(3)两位同学又请来老师帮忙,老师选取另外一种测定方法经反复测定结果都是96.3%,请你结合实验过程分析一下两位同学谁的测定结果不准确,为什么?



 Na2CO3+CO2↑+H2O;③NaHCO3+HCl═NaCl+CO2↑+H2O;④少量的NaHCO3与Ca(OH)2反应:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
Na2CO3+CO2↑+H2O;③NaHCO3+HCl═NaCl+CO2↑+H2O;④少量的NaHCO3与Ca(OH)2反应:NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O