题目内容
【题目】元素周期表对学习化学有重要的帮助。下表是依据元素周期表画出的原子序数1—18号元素的原子结构示意图,请回答:
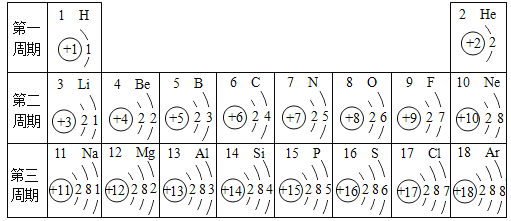
(1)原子序数为16的元素,它的名称是____,它的最外层电子数为____,在化学反应中,该元素的原子易_____(选填“得到”或“失去")电子,变成____(填粒子符号),该离子属于_____(选填“阳离子”或“阴离子")。
(2)由l3、17号元素组成的一种化合物的化学式为______。
(3)2006年世界十大科技进展中,有一项是由美国和俄罗斯科学家共同合成了原子序数为118的超重元素,则此元素的质子数为_____。
(4)对上表进行分析研究,发现有很多规律,请写出其中一条:例如:规律①原子序数与元素原子核电荷数相等。规律②______________________________。
【答案】硫 6 得到 S2- 阴离子 AlCl3 118 同一周期,从左到右,质子数依次递增1/同一周期,从左到右,最外层电子数依次由1递增到8
【解析】
(1) 根据元素周期表可知,原子序数为16的元素名称是硫,最外层电子数是6,在化学反应中容易得到两个电子,变成硫离子,符号为S2-,该离子属于阴离子;
(2) l3、17号元素分别是 Al和Cl,组成的一种化合物的化学式为 AlCl3;
(3) 在原子中,原子序数=质子数=核外电子数,则原子序数为118的超重元素的质子数为118;
(4) 根据元素周期表画出的原子序数1-18号元素的原子结构示意图,观察比较可总结出规律有:原子的电子层数等于所在周期数;同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同;最右纵行的原子结构均为稳定结构;金属相对集中于左偏下区域;非金属集中于右边的区域;同一周期原子的最外层电子数从左到右逐渐增加等。

 阅读快车系列答案
阅读快车系列答案【题目】氢氧化钡与氢氧化钙同属于碱类物质,其化学性质相似吗?某兴趣小组的同学对此进行探究。
Ⅰ.定性探究
序号 | 操作 | 现象 | 结论 |
实验一 | 向氢氧化钡溶液中滴入_____试剂 | 溶液变红 | 氢氧化钡溶液呈碱性 |
实验二 | 向实验一的溶液中通入适量的二氧化碳 | 产生_____, 红色消失 | 氢氧化钡溶液能与 二氧化碳反应 |
实验三 | 另取氢氧化钡溶液,滴入一定量 的碳酸钠溶液 | 产生白色沉淀 | 氢氧化钡溶液能与 碳酸钠溶液反应 |
(1)写出实验三中发生反应的化学方程式_____;
同学们将上述三个实验中反应后的废液都倒入一个烧杯中,过滤后,得到白色沉淀和红色滤液,他们决定对沉淀和滤液进行探究。
探究一:(提出问题)沉淀能否与酸发生反应?
(实验探究)向沉淀中加入足量的稀硫酸,观察到有气泡产生,最终沉淀_____(填“消失”或“不消失”)。
探究二:(提出问题)滤液中除指示剂外,还有哪些溶质?
(作出猜想)①氢氧化钠, ②氢氧化钠、碳酸钠, ③_____。
(实验探究)
序号 | 操作 | 现象 | 结论 |
实验四 | 取滤液样品于试管中, 加入几滴稀盐酸 | 没有明显现象 | 猜想②不成立 |
实验五 | 取滤液样品于试管中, 加入几滴碳酸钠溶液 | 产生沉淀 | 猜想_____成立 |
(2)有同学提出:实验四的操作存在问题,导致结论不准确,请你改正:_____。
(3)小组同学讨论后发现,只用一种溶液做一次实验,就可以验证猜想,该溶液是_____。
Ⅱ.定量探究
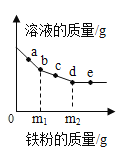
向100g氢氧化钡溶液中滴加溶质质量分数为10%的硫酸铜溶液,溶液的导电能力随着硫酸铜溶液的加入发生如图的变化关系。
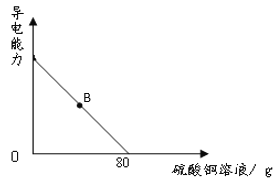
(1)溶液处于B点时,其中含有的是_____、_____、_____(填微粒符号)。
(2)计算氢氧化钡溶液的溶质质量分数_____。