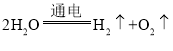题目内容
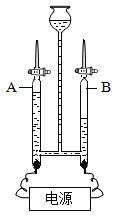
【题目】为了除去NaCI溶液中含有少最的MgC12、CaC12和Na2SO4等杂质,某小组同学选用Na2CO3溶液、稀盐酸、Ba(OH)2溶液三种试剂,按一定的顺序进行如图所示的实验。
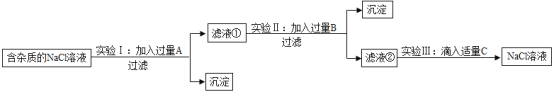
回答下列问题:
(1)实验I中加入试剂A除去的杂质是_____;
(2)实验II中加入的试剂B是_____溶液;
(3)滤液②中除Na+和Cl-外,还含有的离子是_____(填离子符号);
(4)实验III中发生的中和反应的化学方程式_____。
【答案】MgCl2和Na2SO4 Na2CO3 CO32-、OH- ![]()
【解析】
(1)除去NaCl溶液中的MgC12、CaC12和Na2SO4,先加入Ba(OH)2溶液除去硫酸根离子和镁离子,然后加入Na2CO3溶液除去钙离子和钡离子,注意Ba(OH)2一定要放在Na2CO3前面,因为Na2CO3不仅要除去钙离子,还要除去过量的钡离子。实验Ⅰ中加入试剂A是氢氧化钡溶液,氢氧化钡与氯化镁反应生成氢氧化镁沉淀和氯化钠,和硫酸钠反应生成硫酸钡沉淀和氯化钠;除去杂质MgCl2和Na2SO4;
(2)实验Ⅱ中加入的试剂B是Na2CO3溶液,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,除去氯化钙和过量的氢氧化钡;
(3)滤液②中除Na+和Cl-外,还含有的离子是过量碳酸钠中的碳酸根离子和反应生成氢氧化钠中的氢氧根离子,符号为CO32-、OH-;
(4)实验Ⅲ中发生氢氧化钠和盐酸反应中和反应生成氯化钠和水,反应的化学方程式:NaOH+HCl=NaCl+H2O。

【题目】下列表中的叙述,对应的化学方程式和所属反应基本类型都正确的是( )
选项 | 叙述 | 化学反应方程式 | 反应类型 |
A | 电解水 |
| 分解反应 |
B | 探究一氧化碳的还原性 |
| 置换反应 |
C | 酸雨形成的原因 |
| 化合反应 |
D | 硫酸铜溶液中滴加氢氧化钠溶液 |
| 复分解反应 |
A.AB.BC.CD.D