题目内容
 26、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
26、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈
实验二:探究碳酸氢钠的热稳定性
[查阅资料]碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
[进行实验]为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①他们猜想的依据是
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表(只要求填写其中一行.若两行都写,按第一行计分):
| 实 验 操 作 | 预期实验现象 | 结 论 |
| 固体产物是Na2CO3,而不是NaOH. | ||
| 固体产物是NaOH, 而不是Na2CO3. |
氢氧化钙和二氧化碳反应能生成碳酸钙和水;
反应前后元素的种类不变,原子的种类和个数不变;
碳酸钠和稀盐酸反应能生成氯化钠、水和二氧化碳,氢氧化钠稀盐酸反应能生成氯化钠和水.
实验二:(1)加热一段时间后,观察到烧杯内壁有水珠.故填:水珠.
(2)氢氧化钙和二氧化碳反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
(3)①兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3的依据是质量守恒定律.故填:质量守恒定律.
②碳酸钠和稀盐酸反应能生成氯化钠、水和二氧化碳,氢氧化钠稀盐酸反应能生成氯化钠和水.
| 实验操作 | 预期实验现象 | 结论 |
| 向固体中加入足量的稀盐酸 | 产生大量气泡 | 固体是碳酸钠 |
| 向固体中加入足量的稀盐酸 | 没有气泡产生 | 固体是氢氧化钠 |

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案小强同学看到妈妈将买来的排水口洗净剂(主要成分:过碳酸钠、柠椒酸)洒在厨房排水口网状盖的底部,倒上温水后有气泡冒出。激发了探究欲望。他决定与学习小组的同学,对所产生气体的成分及排水口洗净剂主要成分的作用进行探究。
[探究活动一]
老师提示:排水口洗净剂与水作用的生成物中有两种常见的气体。同学们根据所学的化学知识设计并进行如左下图所示的实验。
实验中观察到如下现象:A中有气泡产生;B中的澄清石灰水变浑浊;C中收集到的气
体能使燃着的木条燃烧更旺。由此同学们得出结论:生![]() 成的两种气体分别是: 和
成的两种气体分别是: 和
。B中有关反应的化学方程式 。
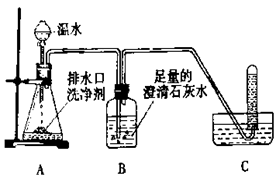 |
[探究活动二]
老师提供了一瓶过碳酸钠( Na2CO4 ),引导同学进行如下实验探究:
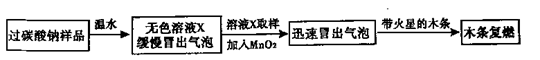 根据上述实验结果得出结论:无色溶液x中含有的一种溶质是 。根据质量守恒定律,同学们对溶液x中还可能存在其它溶质作出如下猜想:
根据上述实验结果得出结论:无色溶液x中含有的一种溶质是 。根据质量守恒定律,同学们对溶液x中还可能存在其它溶质作出如下猜想:
① Na2CO3 ②NaHCO3 ③Na2CO3和NaHCO3的混合物。
资料摘要I:氯化钙溶液呈中性;氯化钙溶液与碳酸氢钠溶液混合不发生反应;氯化钙溶液
与碳酸钠溶液混![]() 合后发生如下反应:Na2CO3 + CaCl2= CaCO3↓+ 2NaC1
合后发生如下反应:Na2CO3 + CaCl2= CaCO3↓+ 2NaC1
资料摘要Ⅱ; NaHCO,溶液呈碱性;碳酸氢钠、碳酸钠分别与足量的酸反应产物相同。
资料摘要Ⅲ :柠檬酸是一种有机酸,与盐酸具有相似的化学性质。
实验验证:
实验步骤[来源:学科网] | 实验现象 | 实验结论 |
a、区上述无色溶液X少量于试管中,至不再冒气泡为止,加入足量的氯化钙溶液 | 产生白色沉淀 | 无色溶液X中含有 |
b、取步骤a所得上层清液少量,滴加
|
| 无色溶液X中不含 |
综合上述两个探究活动的结果,同学们明确了上述猜想 (填序号)是正确的。请你简述在排水口洗净剂与水接触产生气体的过程中,柠檬酸所起的相关作用: 。