题目内容
某工厂排放的废硫酸,拟选用下列物质与之反应:
| 物质 | 相对分子质量 | 市场参考价(元/吨) |
| CaCO3 | 100 | 1.8 |
| Ca(OH)2 | 74 | 2.0 |
| NaOH | 40 | 11.5 |
(2)若要中和500t 9.8%的废硫酸,需要多少吨的氢氧化钠?需花费多少元?反应后所得硫酸钠溶液溶质的质量分数是多少?
(有关反应的化学方程式:CaCO3+H2SO4=CaSO4+H2O+CO2↑ Ca(OH)2+H2SO4=CaSO4+2H2O 2NaOH+H2SO4=Na2SO4+2H2O)
解:(1)在硫酸钙、硫酸钠中都含有一个硫酸根离子,假设都只生成一个硫酸根离子需要另一种离子的质量分别为:钙:40,钠:46,再通过价格一算氢氧化钠最贵,现在主要是比较碳酸钙和氢氧化钙,假设钙都是40千克,则需碳酸钙:100千克,价格为180元.需氢氧化钙74千克,价格148元,所以最便宜的是氢氧化钙.
故选:Ca(OH)2
(2)解:设需要NaOH的质量为x,反应生成的Na2SO4质量为y;
2NaOH+H2SO4=Na2SO4+2H2O
80 98 142
x 500t×9.8% y
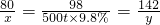
x=40t y=71t
用NaOH所需的费用=40t×l000kg/t×11.5元/Kg=460000元
反应后所得硫酸钠溶液溶质的质量分数为: ×100%=13.1%
×100%=13.1%
答:反应后所得硫酸钠溶液溶质的质量分数为13.1%
分析:根据碳酸钙与硫酸反应能生成硫酸钙,氢氧化钙与硫酸反应也能生成硫酸钙,氨气与硫酸反应生成硫酸铵,氢氧化钠与硫酸反应生成硫酸钠,都结合了一个硫酸根离子,再去计算需要另一种离子的质量和价格就行了.
点评:解答本题可用数据分析法,即解题时正确分析数据,找出数据的变化特征及彼此之间的关系,将综合复杂的问题分解为简单的计算,从而顺利解题.
故选:Ca(OH)2
(2)解:设需要NaOH的质量为x,反应生成的Na2SO4质量为y;
2NaOH+H2SO4=Na2SO4+2H2O
80 98 142
x 500t×9.8% y
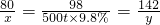
x=40t y=71t
用NaOH所需的费用=40t×l000kg/t×11.5元/Kg=460000元
反应后所得硫酸钠溶液溶质的质量分数为:
 ×100%=13.1%
×100%=13.1% 答:反应后所得硫酸钠溶液溶质的质量分数为13.1%
分析:根据碳酸钙与硫酸反应能生成硫酸钙,氢氧化钙与硫酸反应也能生成硫酸钙,氨气与硫酸反应生成硫酸铵,氢氧化钠与硫酸反应生成硫酸钠,都结合了一个硫酸根离子,再去计算需要另一种离子的质量和价格就行了.
点评:解答本题可用数据分析法,即解题时正确分析数据,找出数据的变化特征及彼此之间的关系,将综合复杂的问题分解为简单的计算,从而顺利解题.

练习册系列答案
相关题目
13、某工厂排放的废硫酸,拟选用下列物质与之中和.如果要求花最少的钱来中和同样量的废硫酸,则应选择( )
|
(2004?东城区二模)某工厂排放的废硫酸,拟选用下列物质与之中和:
|
某工厂排放的废硫酸,拟选用下列物质与之中和
|
某工厂排放的废硫酸,拟选用下列物质与之反应:
(1)如果要求花最少的钱来中和同样量的废硫酸,则应选择的物质是______.
(2)若要中和500t 9.8%的废硫酸,需要多少吨的氢氧化钠?需花费多少元?反应后所得硫酸钠溶液溶质的质量分数是多少?
(有关反应的化学方程式:CaCO3+H2SO4=CaSO4+H2O+CO2↑ Ca(OH)2+H2SO4=CaSO4+2H2O 2NaOH+H2SO4=Na2SO4+2H2O)
| 物质 | 相对分子质量 | 市场参考价(元/吨) |
| CaCO3 | 100 | 1.8 |
| Ca(OH)2 | 74 | 2.0 |
| NaOH | 40 | 11.5 |
(2)若要中和500t 9.8%的废硫酸,需要多少吨的氢氧化钠?需花费多少元?反应后所得硫酸钠溶液溶质的质量分数是多少?
(有关反应的化学方程式:CaCO3+H2SO4=CaSO4+H2O+CO2↑ Ca(OH)2+H2SO4=CaSO4+2H2O 2NaOH+H2SO4=Na2SO4+2H2O)