题目内容
【题目】某化工厂的生产流程如下图所示:

(1)生产流程①的基本反应类型是__________反应。
(2)二氧化碳中碳元素的化合价是________。
(3)生产流程④中有关反应的化学方程式为________。
(4)生产流程③中要得到7.4千克熟石灰,至少需加入________千克的水。
【答案】分解 +4 Ca(OH)2+Na2CO3 === CaCO3↓+2NaOH 1.8
【解析】
本题通过碳酸钙、生石灰、熟石灰之间的转化,考查了反应类型的判定,有关化合价的计算,根据化学方程式的计算,化学方程式的书写。
(1)生产流程①是碳酸钙高温下分解生成氧化钙和二氧化碳,该反应是由一种物质生成物两种物质,基本反应类型是分解反应;
(2)二氧化碳中氧元素的化合价是-2,设:二氧化碳中碳元素的化合价为x,根据化合物中元素化合价为零,则有x+(+2)×2=0,x=+4;
(3)生产流程④是氢氧化钙与碳酸钠反应生成氢氧化钠和碳酸钙,反应的化学方程式为Ca(OH)2+Na2CO3 === CaCO3↓+2NaOH;
(4)设;至少需加入水的质量为x。
CaO+H2O=Ca(OH)2
18 74
x 7.4Kg
![]()
![]() x=1.8Kg。要得到7.4千克熟石灰,至少需加入1.8千克的水
x=1.8Kg。要得到7.4千克熟石灰,至少需加入1.8千克的水

【题目】请回答相关问题:
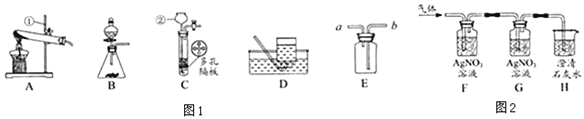
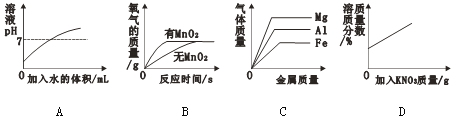
(1)氧气制备是中学化学的经典实验。上世紀的教材上制取O2常使用KClO3和MnO2,下列装置中适用于该原理制取和收集O2的是____(填編号)。实验后回收催化剂MnO2的操作是___________。

(2)下表中一定呈碱性的是______;胃酸(主要是盐酸)过多可用NaHCO3治疗,其反应化学方程式是_______________。
选项 | A | B | C |
体液 | 胃液 | 唾液 | 血液 |
pH | 0.9~15 | 6.6-7.1 | 7.35-7.45 |
【题目】下表是NaCl、KNO3在不同温度时的溶解度:
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
据此数据,判断下列说法错误的是
A. KNO3和NaCl的溶解度曲线在20℃—30℃温度范围内会相交
B. 在60℃时,KNO3的饱和溶液105g加入95g水后,溶液中溶质的质量分数为27.5%
C. 在20℃时,NaCl和KNO3固体各35g分别加入两只各盛有100g水的烧杯中,均不能形成饱和溶液
D. 从含有少量NaCl的KNO3饱和溶液中得到较多的KNO3晶体,通常可采用冷却热饱和溶液的方法
【题目】我国科技创新成果斐然,下列成果中以制备非金属单质为主要目的的是
A | B | C | D |
|
|
|
|
低温制备H2 | 成功开采可燃冰 (CH4·nH2O) | 研制出超高强碳钢 | 合成全氮阴离子盐 (N5)6(H3O)3(NH4)4Cl |
A. A B. B C. C D. D