题目内容
学习氢氧化钠的性质之后,知道氢氧化钠溶液中含有H2O、Na+、OH-,能使无色酚酞溶液变红色,某科技小组想进一步探究是哪一种粒子使无色酚酞溶液变红色。
【提出猜想】猜想①:可能是H2O;
猜想②:可能是Na+;
猜想③:可能是OH-。
【实验验证】
实验操作 | 实验现象 | 结? 论 |
①用试管取少量蒸馏水,滴入1滴~2滴无色酚酞溶液,振荡 | 试管内溶液仍为无色 | 水分子不能使无色酚酞溶液变红色 |
②用试管取少量氯化钠溶液,滴入1滴~2滴无色酚酞溶液,振荡 |
|
|
③用试管取少量氢氧化钠溶液,滴入1滴~2滴无色酚酞溶液,振荡 |
|
|
【讨论反思】有同学认为猜想①不需要实验验证就可以排除,你认为该同学的理由是__________________________。
【答案】
【实验验证】试管内溶液仍为无色???? Na+不能使无色酚酞溶液变红色
试管内溶液变为红色??? OH-能使无色酚酞溶液变红色
【讨论反思】无色酚酞溶液中有大量水分子,已经证明水分子不能使酚酞变红色
【解析】根据碱的共性,氢氧化钠溶液中含有H2O、Na+、OH-,能使无色酚酞溶液变红色的是OH-,所以取少量氯化钠溶液,滴入1滴~2滴无色酚酞溶液,由于氯化钠溶液中没有OH-,试管内溶液仍为无色,同时也会证明Na+不能使无色酚酞溶液变红色,从而也得出结论OH-能使无色酚酞溶液变红色。由于无色酚酞溶液中有大量水分子,已经证明水分子不能使酚酞变红色。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
甲、乙两个研究性学习小组分别制备氨气,并利用氨气的性质(氨气与灼热的氧化铜反应,生成铜、水和氮气)来验证分子中氮、氢原子个数比,设计了如下实验流程:
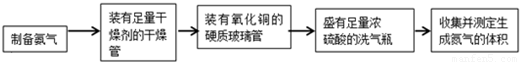
实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
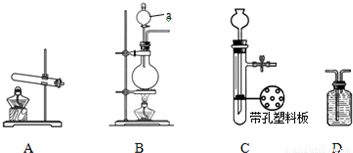
下图A、B、C为甲、乙两小组制备氨气时可能用到的装置,D为盛有足量浓硫酸的洗气瓶.
甲小组测得:反应前氧化铜的质量为m1g、氧化铜反应后转化成的铜的质量为m2g;生成的氮气在标准状况下的体积V1L(已知标准状况下,22.4L氮气的质量是28g).
乙小组测得:洗气前装置D的质量m3g、洗气后装置后D的质量m4g;生成的氮气在标准状况下的体积V2L.
请回答下列问题:
(1)写出仪器a的名称:
(2)检查A装置气密性的具体操作方法是 .
(3)甲、乙两小组选择了不同方法制备氨气,请将实验装置的字母编号和制备原理填写在下表空格中.
(4)甲小组用所测数据计算出氨分子中氮、氢的原子个数之比为 .
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比小于理论值,其原因是 . 为此,乙小组在原有实验流程的基础上,在 的位置增加了一个装有足量药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,也得出了合理的实验结果.该药品的名称是 .

实验中,先用制得的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜.反应完成后,黑色的氧化铜转化为红色的铜.
下图A、B、C为甲、乙两小组制备氨气时可能用到的装置,D为盛有足量浓硫酸的洗气瓶.

甲小组测得:反应前氧化铜的质量为m1g、氧化铜反应后转化成的铜的质量为m2g;生成的氮气在标准状况下的体积V1L(已知标准状况下,22.4L氮气的质量是28g).
乙小组测得:洗气前装置D的质量m3g、洗气后装置后D的质量m4g;生成的氮气在标准状况下的体积V2L.
请回答下列问题:
(1)写出仪器a的名称:
(2)检查A装置气密性的具体操作方法是 .
(3)甲、乙两小组选择了不同方法制备氨气,请将实验装置的字母编号和制备原理填写在下表空格中.
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | ② | 浓氨水、氢氧化钠 |
(5)乙小组用所测数据计算出氨分子中氮、氢的原子个数比小于理论值,其原因是 . 为此,乙小组在原有实验流程的基础上,在 的位置增加了一个装有足量药品的实验仪器,重新实验.根据实验前后该药品的质量变化及生成氮气的体积,也得出了合理的实验结果.该药品的名称是 .