��Ŀ����
����Ŀ���ס��ҡ������ֹ������ʣ��ס��ҡ����������ᾧˮ�����ܽ��������ͼ��ʾ������˵������ȷ����
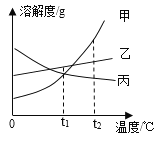
A. t1��ʱ���ס����������ʵ��ܽ�����
B. t2��ʱ�����������ļס��ҡ����ֱ���ɱ�����Һ������ˮ����������>��>��
C. ������к������������ң��ɲ�����ȴ�ȱ�����Һ�ķ����ᴿ��
D. t2��ʱ�����ס��ҡ����ı�����Һ�ֱ�����t1�棬������Һ����������������С��ϵΪ����>��>��
���𰸡�B
��������A.�������ʵ��ܽ�ȷ������
B.���ݱ�����Һ���������������
C. �������ʵ��ܽ�����¶�Ӱ����������ᴿ���ʵķ�����
D. �����ʵ��ܽ�����¶ȱ仯�����������Һ���������������ļ���ʽ�������
�⣺A.��ͼ��֪��t1��ʱ���ס����������ʵ��ܽ�������ཻ����t1��ʱ���ס����������ʵ��ܽ����ȡ���ȷ��
B.����t2��ʱ�ס��ҡ����������ʵ��ܽ�ȴ�С��ϵ�Ǽ�>��>��������������ˮ���ܽ����������Ϊ��>��>���������õ������ļס��ҡ������t2��ʱ������Һ����ˮ�������DZ�>��>�ס��ʴ���
C. ���ڼ����ʵ��ܽ�����¶ȵ����߶����������¶ȵ�Ӱ��仯�ϴ��������л�������������ʱ���ɲ�����ȴ�ȱ�����Һ�ķ����õ��ϴ����ļ����ʡ�����ȷ��
D.��ͼ��֪���ס��ҵ��ܽ�����¶ȵ����߶��������ܽ�����¶ȵ����߶���С�����Խ�t2���ʱ�ס��ҡ����������ʵı�����Һ��������t1��ʱ���ס����������壬��Ȼ�DZ�����Һ�����ܽ���������������������䡣��t1��ʱ�ס������ܽ����ͬ����ʱ�ס�������������������ȣ��ݱ���ʱ���������ļ���ʽ![]() ��100%����֪�ܽ��Խ����������Ҳ��Խ��t2��ʱ�����ס��ҡ����ı�����Һ�ֱ�����t1�棬������Һ����������������С��ϵΪ����>��>������ȷ��
��100%����֪�ܽ��Խ����������Ҳ��Խ��t2��ʱ�����ס��ҡ����ı�����Һ�ֱ�����t1�棬������Һ����������������С��ϵΪ����>��>������ȷ��
��˱���ѡB��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
