题目内容
【题目】某同学将溶质质量分数为20%的氢氧化钠溶液逐滴滴入129.8g硫酸和硫酸铜的混合溶液中,直至过量.加人氢氧化钠溶液的质量(横轴)与混合溶液中溶质质量(纵轴)的关系如图所示. 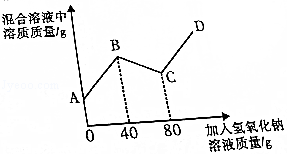
(1)AB段,表示与氢氧化钠溶液的反应.
(2)C点时,溶液中溶质质量分数是多少?
【答案】
(1)硫酸
(2)解:由图可以看出,40g的氢氧化钠溶液和硫酸反应,40g的氢氧化钠溶液和硫酸铜反应.根据质量守恒定律可知,两次生成的硫酸钠的质量相等.
设和硫酸铜反应时生成的氢氧化铜的质量为x,生成的硫酸钠的质量为y
CuSO4+ | 2NaOH= | Cu(OH)2↓+ | Na2SO4 |
80 | 98 | 142 | |
40g×20% | x | y |
![]() =
= ![]() =
= ![]()
x=9.8g
y=14.2g
则生成的全部的硫酸钠的质量为14.2g+14.2g=28.4g
则C点时,溶液中溶质质量分数为 ![]() ×100%=14.2%
×100%=14.2%
答:C点时,溶液中溶质质量分数是14.2%.
【解析】解:(1)由于氢氧化铜在酸中是可溶的,所以应该是氢氧化钠先和硫酸反应,待硫酸完全反应后氢氧化钠才和硫酸铜反应.所以AB段,表示 硫酸与氢氧化钠溶液的反应. 答:(1)AB段,表示 硫酸与氢氧化钠溶液的反应.
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

 阅读快车系列答案
阅读快车系列答案【题目】某同学在做“唾液淀粉酶的消化作用”实验中,记录了下表数据.该实验表明酶的催化作用( )
试管 | 加入物质 | pH | 温度 | 碘液检验 |
1 | 淀粉糊+唾液 | 7 | 37℃ | 不变蓝 |
2 | 淀粉糊+唾液 | 7 | 87℃ | 变蓝 |
A.需要适宜的温度
B.具有专一性
C.需要适宜的pH
D.具有高效性
【题目】下表是某食品包装袋上的说明.
配料 | 蛋白质 | 脂肪 | R | 硫酸锌 | 维生素C |
质量 | 14.8g | 11.6g | 70g | 55g | 11g |
①从表中看出,配料中不属于有机物的 .
②配料表中R处字迹不清,猜想可能是淀粉,可用(填物质名称)与该食品作用是否显蓝色来证实.