题目内容
化学兴趣小组的同学对某炼铁厂生产的生铁(杂质不与酸反应)进行组成分析.其实验数据如下表| 实验步骤 | 相关数据 |
| 1.称取生铁样品放入烧杯中 | 16g |
| 2.加入足量15%的盐酸 | 200.0g |
| 3.称取反应后烧杯中物质总质量 | 215.5g |
(1)产生氢气的质量;
(2)生铁样品中铁的质量;
(3)生铁中铁的质量分数.
分析:根据生成氢气的质量可以求出铁的质量,根据铁的质量可以求出生铁中铁的质量分数.
解答:解:(1)产生氢气的质量:(200g+16g)-215.5g=0.5g.
答:生成氢气的质量为0.5g.
(2)解设生铁中铁的质量为x
Fe+2HCl=FeCl2+H2↑
56 2
x 0.5g
=
x=
=14g.
答:铁的质量为14g.
(3)生铁样品中铁的质量分数:
×100%=87.5%.
答:生铁样品中铁的质量分数:87.5%.
答:生成氢气的质量为0.5g.
(2)解设生铁中铁的质量为x
Fe+2HCl=FeCl2+H2↑
56 2
x 0.5g
| 56 |
| x |
| 2 |
| 0.5g |
x=
| 56×0.5g |
| 2 |
答:铁的质量为14g.
(3)生铁样品中铁的质量分数:
| 14g |
| 16g |
答:生铁样品中铁的质量分数:87.5%.
点评:解答本题要掌握根据化学方程式进行计算的方法,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目


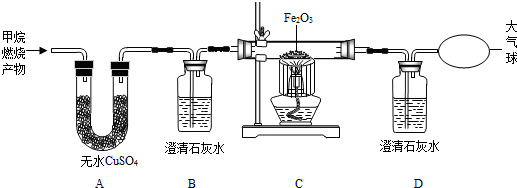
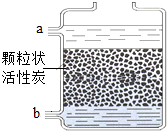 (2012?防城港)某校化学兴趣小组的同学对学校附近小河的水质状况进行了相关的调查研究.
(2012?防城港)某校化学兴趣小组的同学对学校附近小河的水质状况进行了相关的调查研究.