题目内容
【题目】黄铜是制作电子元件的重要材料。为测定某黄铜(假设合金中仅含铜、锌)中锌的质量分数.兴趣小组同学进行了如下图所示的实验(同种盐酸分两次加人) ,请计算:
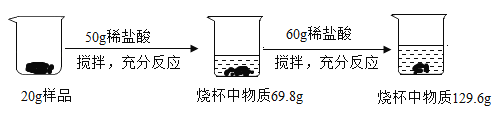
(1)生成氢气的总质量_______g;
(2)该黄铜中锌的质量分数______;(计算结果精确至1%)
(3)所用稀盐酸的溶质质量分数_____。(计算结果精确至0.1%)
【答案】0.4 65% 14.6%
【解析】
(1)据质量守恒定律可知,反应前后物质的总质量不变,生成氢气的总质量50g+20g+60g-129.6g=0.4g ;
(2)设20g黄铜样品中锌的质量为x;参加反应的HCI的质量为y;
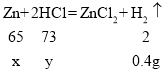
![]()
则解得x=13g
![]()
则解得y=14.6g
则该黄铜中锌的质量分数为:![]()
(3)由生产氢气的质量可知,参加反应的盐酸溶液是100g,所用稀盐酸的质量分数= ![]() 。
。
答:该黄铜中锌的质量分数为65%;所用稀盐酸的质量分数是14.6%

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目