题目内容
(2013?江西模拟)某化学探究活动小组的小峰同学为了测定某不纯氧化铁试样(其中的杂质不参与反应)中氧化铁的质量分数,设计了如图所示的实验装置.(注:3H2+Fe2O3
2Fe+3H2O)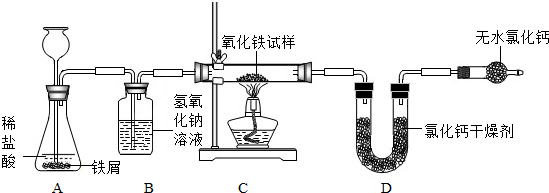
试回答下列问题:
(1)写出A中发生反应的化学方程式:
(2)若已知C中玻璃管的质量为100g,并称量了以下相关数据:
若要计算试样中氧化铁的质量分数,应按上图中哪一个方案来计算更为准确
| ||

试回答下列问题:
(1)写出A中发生反应的化学方程式:
Fe+2HCl=FeCl2+H2↑
Fe+2HCl=FeCl2+H2↑
.(2)若已知C中玻璃管的质量为100g,并称量了以下相关数据:
| 质量g | 反应前 | 反应后 |
| ①C中玻璃管与样品质量 | 120g | 115.2g |
| ②D中U型管与干燥剂质量 | 200g | 206g |
①
①
(填①或②),通过该方案计算得出试样中氧化铁的质量分数为80%
80%
;若按另一方案计算中出的结果和实际值相比将偏大
偏大
(填“偏大”、“偏小”或“相同”).分析:通过实验分析可知:A中是铁与盐酸反应生成氯化亚铁和氢气,配平即可;由实验装置图和表格数据可知:方案①来计算更为准确,因为方案二中的氢气没有干燥,因此装置D中增加的质量是两部分水的和,所以按照方案二计算的结果和实际值相比将偏大;根据方案一的数据可得氧元素的质量=120g-115.2g=4.8g,氧化铁的质量=4.8g÷
=16g,
×100%=80%.
| 48 |
| 160 |
| 16g |
| 120g-100g |
解答:解:(1)A中是铁与盐酸反应生成氯化亚铁和氢气,配平即可,故答案为:Fe+2HCl=FeCl2+H2↑;
(2)由实验装置图和表格数据可知:方案①来计算更为准确,因为方案二中的氢气没有干燥,因此装置D中增加的质量是两部分水的和,所以按照方案二计算的结果和实际值相比将偏大;根据方案一的数据可得氧元素的质量=120g-115.2g=4.8g,氧化铁的质量=4.8g÷
=16g,
×100%=80%.故答案为:①;80%;偏大;
(2)由实验装置图和表格数据可知:方案①来计算更为准确,因为方案二中的氢气没有干燥,因此装置D中增加的质量是两部分水的和,所以按照方案二计算的结果和实际值相比将偏大;根据方案一的数据可得氧元素的质量=120g-115.2g=4.8g,氧化铁的质量=4.8g÷
| 48 |
| 160 |
| 16g |
| 120g-100g |
点评:本考点通过实验探究物质的组成成分,又考查了化学方程式的书写和有关的计算等,还对实验进行了评价,综合性比较强,有关的计算要准确.实验探究题是近几年中考的热点之一,同学们要具体分析,综合掌握.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目