题目内容
请根据如图提示,自编一道简单的计算题,并解答.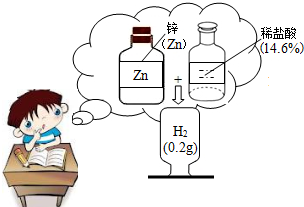
(1)自编的题目:
解答:
(2)若用密度为1.18g?cm-3、溶质质量分数为37%的浓盐酸来配制上图中的稀盐酸100g,需要浓盐酸和水各多少毫升?(水的密度为1.0g?cm-3)
分析:在编制题目是用上图片中所给的信息.并且在编制时,因要写计算过程,所以编制的题目一定自己能很简单的做出来.
解答:自编题型:多少克锌与足量稀盐酸反应产生0.2g氢气?
解:(1)设生成0.2克氢气所需锌的质量为x
Zn+2HCL═ZnCl2+H2↑
65 2
x 0.2g
=
x=6.5g
答:生成0.2克氢气所需锌的质量为6.5g.
(2)设需浓盐酸的体积为x
x×1.18g?cm-3×37%=100g×14.6%
解:x≈33.4mL
需水的体积:
=60.5mL
答:需要浓盐酸和水分别是3.3mL,60.5mL.
解:(1)设生成0.2克氢气所需锌的质量为x
Zn+2HCL═ZnCl2+H2↑
65 2
x 0.2g
| 65 |
| x |
| 2 |
| 0.2g |
x=6.5g
答:生成0.2克氢气所需锌的质量为6.5g.
(2)设需浓盐酸的体积为x
x×1.18g?cm-3×37%=100g×14.6%
解:x≈33.4mL
需水的体积:
| 100g-33.4mL×1.18g/m3 |
| 1g/m3 |
答:需要浓盐酸和水分别是3.3mL,60.5mL.
点评:此题充分体现了开放性、自主性,是对学生思考问题的方法和思考、解决问题的过程和考核促进学生从“学会”向“会学”转变

练习册系列答案
相关题目

