题目内容
先阅读下列短文,再回答下列问题:

在酸性条件下,次氯酸钠(NaClO)、过氧化氢都有很强的氧化性,可将Fe2+氧化为Fe3+.Mg(OH)2和Fe(0H)3在溶液中生成时呈胶状物或絮状物沉淀,而MgCO3在水中煮沸可转变为Mg(OH)2.“卤块”的主要成分为MgCl2,还含有FeCl2、FeCl3、MnCl2等杂质.若以它为原料,按如图工艺流程即可制得“轻质氧化镁”.若要求产品不含杂质离子,而且成本较低,流程中所用试剂或pH控制可参考表1、表2来确定.
表1:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)2 | 2.7 | 3.7 |
| Fe(OH)3 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 工业品 | 规格 | 价格(元/吨) |
| 漂液 | 含NaClO 25.5% | 450 |
| 过氧化氢 | 含H2O230% | 240 |
| 烧碱 | 含NaOH 98% | 2100 |
| 纯碱 | 含Na2CO3 99.5% | 600 |
| 卤块 | 含MgCl2 30% | 310 |
(1)写出盐酸溶液中NaClO将FeCl2氧化成FeCl3,同时生成NaCl和H2O的化学方程式:________,写出在盐酸溶液中H2O2将FeCl2氧化成FeCl3,同时生成H2O的化学方程式:________.
(2)在步骤2中加入物质X,最佳的选择应是________,理由是________.
(3)在步骤3中加入的物质应是________,之所以要控制pH=9.8,其目的是________.
(4)在步骤4中加入物质应是________.
(5)在步骤5中发生的化学方程式为________.
解:(1)NaClO将FeCl2氧化成FeCl3,同时生成NaCl和水,H2O2将FeCl2氧化成FeCl3,并生成了水,所以本题答案为:NaClO+2FeCl2+2HCl═2FeCl3+NaCl+H2O,H2O2+2HCl+2FeCl2═2FeCl3+2H2O;
(2)要加入的X为过氧化氢或次氯酸钠,根据反应的原理可以看出,次氯酸钠作为氧化剂反应后生成氯化钠杂质,而过氧化氢生产的是水,且次氯酸钠的价格高于过氧化氢,所以加入过氧化氢合适,所以本题答案为:过氧化氢,使用H2O2溶液成本低,且不含其他杂质离子;
(3)要得到较为纯净的氧化镁,需将卤块中含有的杂质除掉,根据表格提供的信息可以看出,氢氧化镁在pH、为9.6时开始形成沉淀,故要控制pH=9.8,所以本题答案为:氢氧化钠,不使氯化镁形成沉淀;
(4)MgCO3在水中煮沸可转化为更难溶的Mg(OH)2,所以加入的Z可以是碳酸钠,所以本题答案为:碳酸钠;
(5)碳酸镁能与水在加热时生成氢氧化镁和二氧化碳,所以本题答案为:MgCO3+H2O Mg(OH)2+CO2↑.
Mg(OH)2+CO2↑.
故答案为:(1)NaClO+2FeCl2+2HCl═NaCl+2FeCl3+H2O;H2O2+2FeCl2+2HCl═2FeCl3+2H2O
(2)过氧化氢溶液;使用H2O2溶液成本低,且不含其他杂质离子
(3)NaOH溶液;使FeCl3、MnCl2都转化为Fe(OH)3、Mn(OH)2沉淀,而大部分MgCl2尚未转化为Mg(OH)2,仍以MgCl2留在滤液中,达到分离杂质的目的
(4)碳酸钠;
(5)MgCO3+H2O Mg(OH)2+CO2↑
Mg(OH)2+CO2↑
分析:根据已有的知识结合题干提供的信息进行分析,在卤块中加入盐酸,能使溶液呈酸性,加入次氯酸钠或过氧化氢能将氯化亚铁氧化为氯化铁,要得到较为纯净的氧化镁,需将卤块中含有的杂质除掉,碳酸钠能与氯化镁反应生产碳酸镁沉淀,加热煮沸碳酸镁能形成氢氧化镁沉淀.
点评:本题考查了物质间的转化,完成此题,可以依据题干提供的信息结合已有的知识进行,书写反应的化学方程式要注意配平,要求同学们加强基础知识的储备,以便灵活应用.
(2)要加入的X为过氧化氢或次氯酸钠,根据反应的原理可以看出,次氯酸钠作为氧化剂反应后生成氯化钠杂质,而过氧化氢生产的是水,且次氯酸钠的价格高于过氧化氢,所以加入过氧化氢合适,所以本题答案为:过氧化氢,使用H2O2溶液成本低,且不含其他杂质离子;
(3)要得到较为纯净的氧化镁,需将卤块中含有的杂质除掉,根据表格提供的信息可以看出,氢氧化镁在pH、为9.6时开始形成沉淀,故要控制pH=9.8,所以本题答案为:氢氧化钠,不使氯化镁形成沉淀;
(4)MgCO3在水中煮沸可转化为更难溶的Mg(OH)2,所以加入的Z可以是碳酸钠,所以本题答案为:碳酸钠;
(5)碳酸镁能与水在加热时生成氢氧化镁和二氧化碳,所以本题答案为:MgCO3+H2O
 Mg(OH)2+CO2↑.
Mg(OH)2+CO2↑.故答案为:(1)NaClO+2FeCl2+2HCl═NaCl+2FeCl3+H2O;H2O2+2FeCl2+2HCl═2FeCl3+2H2O
(2)过氧化氢溶液;使用H2O2溶液成本低,且不含其他杂质离子
(3)NaOH溶液;使FeCl3、MnCl2都转化为Fe(OH)3、Mn(OH)2沉淀,而大部分MgCl2尚未转化为Mg(OH)2,仍以MgCl2留在滤液中,达到分离杂质的目的
(4)碳酸钠;
(5)MgCO3+H2O
 Mg(OH)2+CO2↑
Mg(OH)2+CO2↑分析:根据已有的知识结合题干提供的信息进行分析,在卤块中加入盐酸,能使溶液呈酸性,加入次氯酸钠或过氧化氢能将氯化亚铁氧化为氯化铁,要得到较为纯净的氧化镁,需将卤块中含有的杂质除掉,碳酸钠能与氯化镁反应生产碳酸镁沉淀,加热煮沸碳酸镁能形成氢氧化镁沉淀.
点评:本题考查了物质间的转化,完成此题,可以依据题干提供的信息结合已有的知识进行,书写反应的化学方程式要注意配平,要求同学们加强基础知识的储备,以便灵活应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
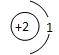 D、原子结构示意图为
D、原子结构示意图为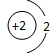
 “嫦娥一号”是我国自主研制、成功发射的第一个月球探测器.“嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列短文并回答有关问题.
“嫦娥一号”是我国自主研制、成功发射的第一个月球探测器.“嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列短文并回答有关问题.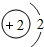 D.属于金属元素,在化学反应中易得到电子
D.属于金属元素,在化学反应中易得到电子
 “嫦娥一号”是我国自主研制、成功发射的第一个月球探测器.“嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列短文并回答有关问题.
“嫦娥一号”是我国自主研制、成功发射的第一个月球探测器.“嫦娥一号”的成功发射,使全国人民欢欣鼓舞.请同学们阅读下列短文并回答有关问题. D.属于金属元素,在化学反应中易得到电子
D.属于金属元素,在化学反应中易得到电子
 D.属于金属元素,在化学反应中易得到电子
D.属于金属元素,在化学反应中易得到电子

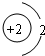 D.属于金属元素,在化学反应中易得到电子
D.属于金属元素,在化学反应中易得到电子
