题目内容
某无色溶液可能由硫酸、氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的一种或几种混合而成.为了分析无色溶液的成分,取少量该无色溶液进行实验,实验方案设计如下:
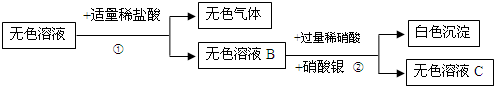
(1)该无色溶液中一定含有 (填化学式,下同),一定没有 .
(2)写出实验步骤?中一定发生的反应化学方程式 .
(3)若修改步骤?中加入的试剂,其它过程和现象不变即可确定一种可能含有物质的存在,步骤?修改后应加入的试剂是 .
(4)如下方案是证明另一种可能含有物质存在的实验片段:
试剂X是 溶液,溶液D是 色.
(5)实验步骤②?和③?都有相同的实验操作,该操作的名称是 .

(1)该无色溶液中一定含有
(2)写出实验步骤?中一定发生的反应化学方程式
(3)若修改步骤?中加入的试剂,其它过程和现象不变即可确定一种可能含有物质的存在,步骤?修改后应加入的试剂是
(4)如下方案是证明另一种可能含有物质存在的实验片段:

试剂X是
(5)实验步骤②?和③?都有相同的实验操作,该操作的名称是
分析:因为碳酸钠能和酸反应生成气体,“无色溶液可能由硫酸、氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的一种”,加适量稀盐酸有气体生成,则推测一定有碳酸钠,则一定没有硫酸,因为二者不能共存;而与硝酸银反应有不溶于硝酸的沉淀生成,则一定含有氯离子,则可推测可能含有的物质.要仔细分析每一实验步骤的用意及实验中所发生的化学反应,从而做出正确的判断.
解答:解:(1)取无色溶液少量,滴加过量稀盐酸溶液,有气体生成,则推测一定有碳酸钠;硫酸与碳酸钠反应,二者不能共存,故一定没有硫酸;向所得无色滤液中加入足量稀硝酸和硝酸银溶液,产生白色沉淀,说明滤液中含有氯离子,由于碳酸钠和稀盐酸反应生成氯化钠,无法确定原溶液中是否含有氯化钠;通过上述实验和现象,还无法确定是否含有氢氧化钠.
要证明氯化钠存在,可取无色溶液少许,加足量稀硝酸充分反应,滴加硝酸银溶液,若仍有沉淀生成,说明含有氯化钠;要证明氢氧化钠是否存在,可取无色溶液少许,加足量氯化钡或氯化钙溶液充分反应,静置,向上层清液中滴加酚酞试液,若溶液变红,则含有氢氧化钠.
(2)实验中,碳酸钠和稀盐酸反应、氯化钠和硝酸银溶液的反应,根据复分解反应的特点,正确书写化学方程式,则Na2CO3+2HCl═2NaCl+H2O+CO2↑;NaCl+AgNO3 =NaNO3 +AgCl↓
(3)若修改步骤?中加入的试剂,其它过程和现象不变即可确定一种可能含有物质的存在,在无色溶液B应加入的试剂是无色酚酞溶液,如果变红,则含有氢氧化钠.
(4)验证氯化钠,则用硝酸银溶液,生成白色沉淀氯化银.
(5)分离可溶和不可溶物质的操作为过滤.
故答案为:(1)Na2CO3,H2SO4.
(2)Na2CO3+2HCl═2NaCl+H2O+CO2↑;NaCl+AgNO3 =NaNO3 +AgCl↓.
(3)无色酚酞溶液.
(4)硝酸银,无.
(5)过滤.
要证明氯化钠存在,可取无色溶液少许,加足量稀硝酸充分反应,滴加硝酸银溶液,若仍有沉淀生成,说明含有氯化钠;要证明氢氧化钠是否存在,可取无色溶液少许,加足量氯化钡或氯化钙溶液充分反应,静置,向上层清液中滴加酚酞试液,若溶液变红,则含有氢氧化钠.
(2)实验中,碳酸钠和稀盐酸反应、氯化钠和硝酸银溶液的反应,根据复分解反应的特点,正确书写化学方程式,则Na2CO3+2HCl═2NaCl+H2O+CO2↑;NaCl+AgNO3 =NaNO3 +AgCl↓
(3)若修改步骤?中加入的试剂,其它过程和现象不变即可确定一种可能含有物质的存在,在无色溶液B应加入的试剂是无色酚酞溶液,如果变红,则含有氢氧化钠.
(4)验证氯化钠,则用硝酸银溶液,生成白色沉淀氯化银.
(5)分离可溶和不可溶物质的操作为过滤.
故答案为:(1)Na2CO3,H2SO4.
(2)Na2CO3+2HCl═2NaCl+H2O+CO2↑;NaCl+AgNO3 =NaNO3 +AgCl↓.
(3)无色酚酞溶液.
(4)硝酸银,无.
(5)过滤.
点评:本题为文字叙述型推断题,掌握常见物质的性质,通过题目给出的信息,在比较鉴别的基础上,得出正确的实验结论,解答时要熟练掌握盐的水溶性,及物质之间的反应,通过实验现象推出物质的组成.

练习册系列答案
相关题目