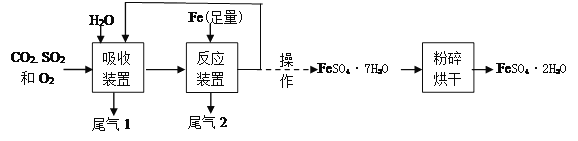
题目内容
【题目】如图是工业生产水煤气的化学反应微观示意图,有关叙述错误的是( )
A.该反应是置换反应
B.图中气体单质的化学式为H2
C.反应后原子的个数减少
D.水煤气泄漏会污染空气
【答案】C
【解析】解:A、由工业生产水煤气的化学反应微观示意图可知,该反应是一种单质和一种化合物反应生成了另一种单质和另一种化合物,属于置换反应,A不符合题意;
B、由微粒的构成可知,图中气体单质的化学式为H2,B不符合题意;
C、由微粒的变化可知,反应后原子的个数不变,C符合题意;
D、水煤气的成分中含有一氧化碳,一氧化碳是有毒的气体,水煤气泄漏会污染空气,D不符合题意.
所以答案是:C.
【考点精析】根据题目的已知条件,利用单质和化合物的判别的相关知识可以得到问题的答案,需要掌握单质与化合物的区别:单质是由同一种元素组成的纯净物.只含有一种元素的物质,但必须是纯净物;化和物:是由不同种元素组成的纯净物.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】下表是某指示剂在一定pH范围内所显示的颜色:
颜色 | 红 | 橙 | 绿 | 蓝 | 紫 |
pH范围 | 1~3 | 4~7 | 6~7 | 8~10 | 11~14 |
向滴有少量该指示剂的稀硫酸中,加入氢氧化钠溶液,出现的颜色变化可能是( )
A.由红变紫
B.由蓝变绿
C.由绿变橙
D.由蓝变紫
【题目】安徽某水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水.)有关实验数据如表:
反应前 | 反应后 | ||
实验 | 烧杯和稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
180g | 12g | 187.6g | |
(1)根据质量守恒定律可知,反应中生成二氧化碳的质量为g.
(2)求该石灰石中碳酸钙的质量分数.
【题目】某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象,硫酸中混有硫酸铜溶液时,产生氢气的速率更快.
【提出问题】是什么离子导致产生氢气的速率加快?
(1)【猜想假设】他们分别对这种意外现象作如下猜想:
甲同学:可能与铜离子有关;
乙同学:可能与硫酸根离子有关;
丙同学认为乙的猜想不科学,理由是 .
(2)【实验证明】用A、B两组仪器进行实验: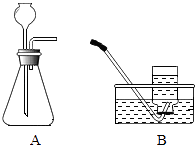
步骤一:检查装置气密性.检查图A所示装置气密性,你采用的方法是 .
步骤二:量取2份质量分数为20%的稀硫酸各20mL,第一份加入质量分数为10%的稀硫酸铜溶液1mL,第二份加入质量分数为10%的硫酸锌溶液1mL,称取2份形状相同锌粒各1g,分别与以上溶液反应,反应装置如图A所示,用此装置实验时,长颈漏斗下端要插入液面以下,目的是 .
实验三:用B收集气体,分别记录收集一瓶气体(集气瓶规格均为125mL)所需的时间(如表),什么时间开始收集气体? .
编号 | 20%的硫酸各20ml | 锌粒 | 收集1瓶氢气所需的时间 |
① | 加入质量分数为10%的硫酸铜溶液1ml | 1g | 2分10秒 |
② | 加入质量分数为10%的硫酸锌溶液1ml | 1g | 3分01秒 |
锌与硫酸反应的化学方程式是 .
(3)【得出结论】硫酸中混有硫酸铜溶液时,产生氢气的速率加快与有关,实验②中加入质量分数为10%的硫酸锌溶液1ml的作用是 .
(4)【反思质疑】丁同学认为:锌与混有硫酸铜的硫酸溶液反应时,产生氢气的速率较快可能与铜单质有关,他质疑的理由是 .
(5)【继续探究】请你设计一个实验方案验证丁同学的观点是否正确.
编号 | 实验步骤 | 实验现象比较 | 实验结论 |
① | 取1g锌粒于锥形瓶中,加入20ml20%的稀硫酸 | 产生氢气的速率较快与铜单质有关 | |
② |