题目内容
宜昌市南津关一带含有丰富的石灰石资源,我们知道,高温煅烧石灰石(主要成分是碳酸钙)可制得生石灰(即氧化钙)和二氧化碳.现有一批石灰石,为了分析产品的纯度,小舜同学取此样品22g,充分煅烧后称得剩余固体的质量为13.2g(提示:假定杂质不反应).计算:
(1)生成二氧化碳的质量是多少g?这些二氧化碳在标准状况下的体积是多少升?(标准状况下CO2密度为1.977g/L)
(2)制得生石灰的质量是多少g?其产品的纯度是多少?
解:(1)生成CO2的质量为:22g-13.2g=8.8g,这些二氧化碳在标准状况下的体积=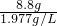 ≈4.45L
≈4.45L
(2)设22g石灰石样品中含CaCO3的质量为x,生成氧化钙的质量为y
CaCO3 CaO+CO2↑
CaO+CO2↑
100 56 44
x y 8.8g
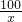 =
=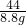
x=20g
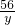 =
=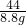
y=11.2g
该石灰石样品的纯度=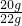 ×100%=90.9%
×100%=90.9%
答:(1)生成二氧化碳的质量为8.8g,在标准状况下的体积为4.45L;(2)制得生石灰的质量是11.2g,该石灰石样品的纯度是90.9%.
分析:(1)石灰石中碳酸钙高温下分解放出的二氧化碳使剩余固体质量减小,因此可利用质量守恒定律,求得分解放出二氧化碳的质量,利用质量与体积间关系,求得生成气体在标准善下的密度;
(2)石灰石样品的纯度即石灰石样品中碳酸钙的质量分数,根据分解反应的化学方程式,由放出二氧化碳的质量计算出样品中所含碳酸钙的质量及生成氧化钙的质量,求出石灰石样品的纯度.
点评:解答时需要注意,剩余固体质量并非氧化钙的质量,其中还含有杂质,因此不能把此数据代入化学方程式进行碳酸钙质量的计算.
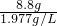 ≈4.45L
≈4.45L(2)设22g石灰石样品中含CaCO3的质量为x,生成氧化钙的质量为y
CaCO3
 CaO+CO2↑
CaO+CO2↑100 56 44
x y 8.8g
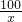 =
=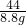
x=20g
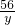 =
=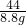
y=11.2g
该石灰石样品的纯度=
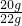 ×100%=90.9%
×100%=90.9%答:(1)生成二氧化碳的质量为8.8g,在标准状况下的体积为4.45L;(2)制得生石灰的质量是11.2g,该石灰石样品的纯度是90.9%.
分析:(1)石灰石中碳酸钙高温下分解放出的二氧化碳使剩余固体质量减小,因此可利用质量守恒定律,求得分解放出二氧化碳的质量,利用质量与体积间关系,求得生成气体在标准善下的密度;
(2)石灰石样品的纯度即石灰石样品中碳酸钙的质量分数,根据分解反应的化学方程式,由放出二氧化碳的质量计算出样品中所含碳酸钙的质量及生成氧化钙的质量,求出石灰石样品的纯度.
点评:解答时需要注意,剩余固体质量并非氧化钙的质量,其中还含有杂质,因此不能把此数据代入化学方程式进行碳酸钙质量的计算.

练习册系列答案
相关题目