题目内容
【题目】实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
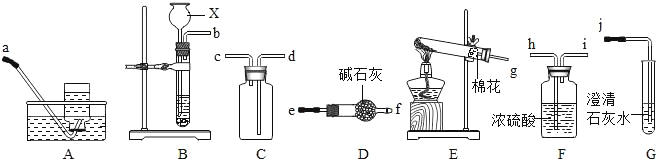
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气,产物中还含有相对分子量最小的氧化物。进行实验时可选择的实验仪器如图所示(省略夹持装置与加热装置):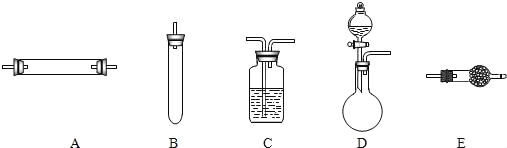
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用____(选填装置编号)。请写出生石灰在此反应中的作用:______
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置______(选填装置编号)中加入_________________以除去其它杂质气体。
(3)方法三:制氮气的化学方程式为_________。
(4)1892年,英国科学家瑞利(( Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大50‰.左右。若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:_____________。
【答案】D生石灰和水反应放热,促使氨水挥发、分解而得到氨气(或降低氨气的溶解度);生石灰与水反应,减少了溶剂E碱石灰NaNO2+NH4Cl![]() NaCl+N2↑+2H2O方法二制得的氮气中含有密度(或相对分子质量)比氮气大的稀有气体,导致密度偏大
NaCl+N2↑+2H2O方法二制得的氮气中含有密度(或相对分子质量)比氮气大的稀有气体,导致密度偏大
【解析】
(1)用CaO和浓氨水反应,应选固液常温型的发生装置,即D;浓氨水常温下跟生石灰反应生成氨气和氢氧化钙,化学方程式为CaO+NH3H2O=NH3↑+Ca(OH)2,因为氨水不稳定易挥发,生石灰和水反应生成熟石灰的过程中,生石灰的两个作用是:一方面消耗氨水溶液中的水,另一方面放出的热量促使氨水挥发、分解而得到氨气;
(2)空气中除了氮气、氧气外,还含有二氧化碳、水蒸气等,为保证所得氨气尽可能纯净,要除去空气中多余的水蒸气、二氧化碳等杂质,可以通过碱性干燥剂-碱石灰,既可以吸收二氧化碳又能吸收水;
(3)根据信息反应物是亚硝酸钠(NaNO2)和氯化铵,反应条件是加热,氮元素全部转化为氮气,反应前后元素的种类不变,因此生成物还有氯化钠和水,因此反应的方程式为:
NaNO2+NH4Cl![]() NaCl+N2↑+2H2O;
NaCl+N2↑+2H2O;
(4)将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末只是除去了氧气,其中还含有稀有气体等杂质,由于稀有气体的密度比氮气密度大,所以导致氮气密度总是偏大5‰左右。

 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】生活中选择适当的清洗剂可以得到更好的清洗效果,根据下表完成问题。
名称 | 洗洁精 | 洁厕灵 | 炉具清洁剂 | 污渍爆炸盐 |
有效成分或功能 | 清洗油污 | 盐酸 | 氢氧化钠 | 过碳酸钠 |
(1)使用洗洁精清洗餐具上的油污,这是因为它具有___________的功能。
(2)以下物质可以使用洁厕灵清洗的是___________。(填字母序号)。
a.铁锈 b.油渍 c.水垢(主要成分为碳酸钙和氢氧化镁)
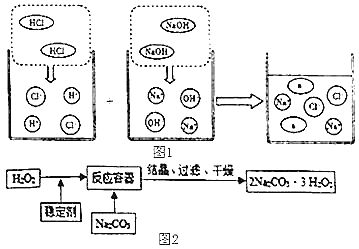
(3)若将洁厕灵与炉具清洁剂混合,可以发生如图1所示的化学反应。图中a微粒的化学式为___________。
(4)“污渍爆炸盐”的主要成分为“过碳酸”(2Na2CO33H2O2),俗称固体双氧水,它既有碳酸盐的性质,又有双氧水的不稳定性和氧化性,是很好的消毒剂,广泛应用于洗涤、印染和医药等领域。“过碳酸钠”的制备流程如图2:
①过滤操作中使用的玻璃仪器有玻璃棒、烧杯和___________,其中玻璃棒的作用是___________。在上述流程中,向反应前的H2O2中加入稳定剂的作用是___________。
②在“过碳酸钠”中加入下列物质时,不会导致“过碳酸钠”变质的是___________
A.稀硫酸
B.硫酸钠
C.二氧化锰
D.澄清石灰水