题目内容
【题目】溶解度可表示物质溶解性的大小。
①氯化钠、硝酸钾的溶解度曲线如图所示,据图回答: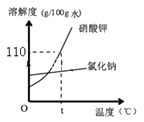
Ⅰ.溶解度变化受温度影响大的是。
Ⅱ.t℃时,将5.5g硝酸钾加入g水中,完全溶解后,恰好得到饱和溶液。要进一步提高该溶液的溶质质量分数,可进行的操作是。
Ⅲ.硝酸钾溶液中含有少量氯化钠,提纯的方法是、、过滤、洗涤、干燥。
②室温时,对100mL硫酸铜饱和溶液作如下图操作,最终甲、乙两烧杯中。
A. 溶质质量:甲<乙 B. 溶剂质量:甲>乙
C. 溶液质量:甲=乙 D. 溶质质量分数:甲=乙
【答案】硝酸钾;5;升温加溶质KNO3;蒸发浓缩;降温结晶;B、D
【解析】
:①Ⅰ、根据图象可以看出,硝酸钾的溶解度随温度的升高变化明显;
Ⅱ、t℃时,硝酸钾的溶解度为110g,故将5.5g硝酸钾加入5.5g÷![]()
![]() =5g水中,完全溶解后,恰好得到饱和溶液;要提高溶液的溶质质量分数,需要升高温度并且加入硝酸钾;
=5g水中,完全溶解后,恰好得到饱和溶液;要提高溶液的溶质质量分数,需要升高温度并且加入硝酸钾;
Ⅲ、硝酸钾的溶解度随温度的升高而增大明显,故硝酸钾溶液中含有少量氯化钠,需要采用降温结晶的方法,故需要先将溶液配成热的饱和溶液,再降温结晶;
②将饱和硫酸铜溶液分成甲和乙,则溶液的中的溶质质量分数相等,甲中加入硫酸铜晶体,硫酸铜晶体含有水和硫酸铜,则溶剂质量增加,溶质质量增加,仍然是饱和溶液,乙中加入硫酸铜粉末,不能继续溶解,仍然是饱和溶液,故甲和乙的溶质质量分数相等;
所以答案是:硝酸钾;5;升温加溶质KNO3;蒸发浓缩;降温结晶;B、D.
【考点精析】本题主要考查了结晶的原理、方法及其应用和饱和溶液和不饱和溶液的相关知识点,需要掌握结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3);饱和与不饱和的判断方法:看有无不溶物或继续加入该溶质,看能否溶解才能正确解答此题.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案