题目内容
【题目】工业用煤燃烧产生二氧化硫,在排放前需经处理,如图是两种除硫工艺中主要物质的转化路径(部分产物已略)。
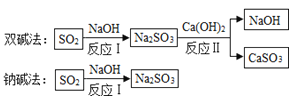
若每1000g Ca(OH)2和NaOH的市场价格分别按0.36元、2.90元计算,下列说法不正确的是( )
A.煤是不能再生的化石燃料
B.反应Ⅰ的化学反应方程式为:SO2+2NaOH=Na2SO3+H2O
C.“双碱法”中的NaOH可以循环使用,节约成本
D.处理相同的SO2,“钠碱法”所需的原料成本更低
【答案】D
【解析】
试题分析:A、煤是不能再生的化石燃料,正确,B、反应Ⅰ的化学反应方程式为:SO2+2NaOH=Na2SO3+H2O,正确,C、在流程中可以循环使用的物质即既是某个反应的反应物,又是另一个反应的生成物, “双碱法”中反应Ⅰ所需的NaOH,通过反应II又产生了NaOH,故可以循环利用,减少了NaOH的用量,所以成本降低,正确,D、 由于“钠碱法” 不能实现了NaOH的循环利用,故处理相同的SO2,“钠碱法”所需的原料成本更高,错误,故选D

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
