题目内容
 (2012?金山区二模)氢氧化钠溶液与稀硫酸反应的化学方程式为
(2012?金山区二模)氢氧化钠溶液与稀硫酸反应的化学方程式为2NaOH+H2SO4═Na2SO4+2H2O
2NaOH+H2SO4═Na2SO4+2H2O
.实验室有一瓶标签残缺的硫酸溶液,为了粗略测定每毫升硫酸溶液中溶质H2SO4的物质的量(单位:mol/mL),其实验步骤如下:①在小烧杯中加入10g、4%的NaOH溶液,用适量的蒸馏水稀释,再滴入2滴
酚酞
酚酞
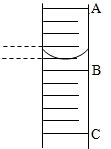
(填指示剂名称)试液.②向10mL量筒中注入该硫酸至一定刻度.量筒中液面的位置如图所示,A与B、B与C刻度间均相差1mL,如果刻度A读数为8.0mL,则量筒中硫酸的体积是
7.2
7.2
mL;③用胶头滴管吸取量筒中的硫酸,逐滴滴入上述烧杯中,一直滴到溶液由
红
红
色恰好变成无
无
色为止,此时量筒中液面的读数为2.2mL④计算确定每毫升硫酸溶液中含溶质H2SO4的物质的量(写出计算过程).
0.001mol
0.001mol
.分析:依据反应事实书写方程式;
①硫酸与氢氧化钠反应无明显现象,滴入酚酞可以知道什么时候恰好完全反应;
②先确定B处的刻度和量筒的分度值再读数,读数时视线要与量筒内液体的凹液面的最低处保持水平;
③酚酞试液由红色恰好变成无色,说明稀硫酸与氢氧化钠溶液恰好完全;
④依据化学方程式的计算并结合氢氧化钠的质量计算即可.
①硫酸与氢氧化钠反应无明显现象,滴入酚酞可以知道什么时候恰好完全反应;
②先确定B处的刻度和量筒的分度值再读数,读数时视线要与量筒内液体的凹液面的最低处保持水平;
③酚酞试液由红色恰好变成无色,说明稀硫酸与氢氧化钠溶液恰好完全;
④依据化学方程式的计算并结合氢氧化钠的质量计算即可.
解答:解:稀硫酸与氢氧化钠溶液反应生成硫酸钠和水,方程式是2NaOH+H2SO4═Na2SO4+2H2O;
故答案为:2NaOH+H2SO4═Na2SO4+2H2O;
①硫酸与氢氧化钠反应无明显现象,滴入酚酞可以知道什么时候恰好完全反应,氢氧化钠溶液中滴入酚酞试液变红,当溶液由红色恰好变为无色时,说明氢氧化钠与硫酸恰好完全反应;
故答案为:酚酞;
②A处的刻度为8,则B处的刻度为7,该量筒的分度值为0.2 ml,读量筒内液体凹液面的最低处,可知量筒中硫酸的体积是7.2ml;
故答案为:7.2;
③氢氧化钠溶液中滴入酚酞试液变红,当溶液由红色恰好变为无色时,说明氢氧化钠与硫酸恰好完全反应;
故答案为:红;无;
④反应掉的氢氧化钠的物质的量是:10g×4%÷40g/mol=0.01mol
设共反应掉硫酸的物质的量是x
2NaOH+H2SO4═Na2SO4+2H2O
2mol 1mol
0.01mol x
=
x=0.005mol
反应中共消耗硫酸溶液的体积为:7.2mL-2.2mL=5.0mL
则每毫升溶液中含溶质H2SO4的物质的量为:
=0.001mol/mL
答:每毫升硫酸溶液中含溶质H2SO4的物质的量0.001mol.
故答案为:2NaOH+H2SO4═Na2SO4+2H2O;
①硫酸与氢氧化钠反应无明显现象,滴入酚酞可以知道什么时候恰好完全反应,氢氧化钠溶液中滴入酚酞试液变红,当溶液由红色恰好变为无色时,说明氢氧化钠与硫酸恰好完全反应;
故答案为:酚酞;
②A处的刻度为8,则B处的刻度为7,该量筒的分度值为0.2 ml,读量筒内液体凹液面的最低处,可知量筒中硫酸的体积是7.2ml;
故答案为:7.2;
③氢氧化钠溶液中滴入酚酞试液变红,当溶液由红色恰好变为无色时,说明氢氧化钠与硫酸恰好完全反应;
故答案为:红;无;
④反应掉的氢氧化钠的物质的量是:10g×4%÷40g/mol=0.01mol
设共反应掉硫酸的物质的量是x
2NaOH+H2SO4═Na2SO4+2H2O
2mol 1mol
0.01mol x
| 2mol |
| 0.01mol |
| 1mol |
| x |
x=0.005mol
反应中共消耗硫酸溶液的体积为:7.2mL-2.2mL=5.0mL
则每毫升溶液中含溶质H2SO4的物质的量为:
| 0.005mol |
| 5.0mL |
答:每毫升硫酸溶液中含溶质H2SO4的物质的量0.001mol.
点评:本题对中和反应进行了综合的考查,解题的关键是对实验原理以及相关计算的掌握,能很好的培养学生分析、应用问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目